Получение и подготовка крови к исследованию.
Кровь рекомендуется брать лучше утром в одни и те же часы (до кормления и водопоя), после отдыха и успокоения животного.
Стабилизация крови.
Для предупреждения свертывания крови используют один из следующих антикоагулянтов (на 10 мл крови): щавелевокислый натрий (калий или аммоний) — 0,01-0,02 г: (оксалатная кровь); лимоннокислый натрий — 0,02 г (цитратная кровь); фтористый натрий — 0,01 г; гепарин — 1 капля раствора, содержащего в I мл 5000 ME гепарина (гепаринизированная кровь). Антикоагулянты вносят в пробирку, в которую затем собирают кровь; пробирку закрывают резиновой пробкой и тщательно смешивают содержимое 1-2 минуты.
Получение сыворотки крови. Собранную в пробирку или стеклянный цилиндр кровь ставят сначала в теплое место (на 15- 20 минут), а потом в холодное. Образовавшийся сгусток отделяют от стенок сосуда стеклянной палочкой или тонкой проволочкой. Полученную сыворотку осторожно отсасывают. Для лучшего отделения сыворотки от сгустка пробирку со свернувшейся кровью можно процентрифугировать 10-15 минут при 2-3 тыс. оборотов.
Получение плазмы.
Стабилизированную кровь наливают в пробирку и центрифугируют 10 минут при 1,5-2,0 тыс. оборотов в минуту. В результате оседания форменных элементов крови в пробирке образуется прозрачная жидкость — плазма, которую отсасывают и переносят в другую пробирку.
Исследование физических свойств крови.
Из физических свойств крови важное диагностическое значение имеет определение ее удельного веса, вязкости и скорости свертывания, а также реакции оседания эритроцитов.
Определение удельного веса крови.
Удельный вес крови опредетяют по методу Гаммершлага (в смеси бензола с хлороформом) или по способу Филиппса (в растворах медного купороса).
В норме удельный вес крови колеблется в следующих пределах: v крупного рогатого скота — 1,040-1,059; овцы — 1,037-1,049, козы — 1,041-1,061; яка — 1,045-1,063, лошади — 1,038- 1 062; свиньи — 1,042-1,060, кошки — 1,053-1,057, собаки — 1 044-1,056, кролика — 1,048-1,060, курицы — 1,039-1,057; гуся — 1,045-1,063.
Повышение удельного веса крови отмечается при поносах, рвоте, лихорадке, экссудативных и транссудативных процессах и гипергидрозах, диабете, нефритах, отравлении угарным газом. Понижение удельного веса наблюдается при истощении и различных анемиях.
Определение вязкости крови.
Вязкость крови определяют вискозиметром Гесса или Детермана. У здоровых животных вязкость крови составляет: у крупного рогатого скота — 4,6-5,2, овцы — 4,4-6,0, козы — 5,0-6,0, верблюда — 4,3-5,3, лошади — 3,4- 7,2, свиньи — 4,0-5,0, собаки — 3,8-5,5, кошки — 4,0-5,0, кролика — 3,5-4,5, курицы — 4,5-5,5.
Повышенная вязкость крови наблюдается при некоторых лихорадочных заболеваниях (плеврите, воспалении легких, перитоните), при сердечной недостаточности в период декомпенсации. Понижение вязкости встречается при первичных и вторичных анемиях, истощении.
Определение скорости свертывания крови.
На край хорошо обезжиренного предметного стекла, поставленного под углом 50°, наносят каплю крови. Стекая по стеклу, капля оставляет след. Через каждые 30 секунд по следу крови проводят острием иглы. Появление нитей фибрина на острие иглы указывает на начало свертывания крови. В норме скорость свертывания крови равна у крупного рогатого скота 5-6, лошади — 8-10, собак — 10 минутам.
Ускорение свертывания крови отмечается при миоглобинурии, крупозном воспалении легких, постгеморрагических анемиях. Замедление свертывания крови встречается при анемиях, нефритах, холемиях, сибирской язве, гемофилии, удушье.
Определение реакции оседания эритроцитов.
Реакцию оседания эритроцитов (РОЭ) нужно определять не позже двух часов после взятия крови. Реакцию оседания эритроцитов определяют или методом Неводова, или методом Панченкова.
Метод Неводова.
РОЭ определяют при помощи эритроседиометра, представляющего собой пробирку длиной 17 см и шириной 9 мм, с делениями от 0 до 100. Объем градуированной части пробирки равен 10 мл. В эритроседиометр вносят 0,02 г щавелевокислого натрия и наполняют кровью до отметки 100, закрывают резиновой пробкой и тщательно смешивают кровь с антикоагулянтом. Пробирку ставят в штатив и отмечают на часах начало исследования. Уровень столба эритроцитов определяют через 15, 30, 45 и 60 минут, а затем через 24 часа.
Метод Неводова обычно используется для определения РОЭ у лошадей. В норме у лошади РОЭ по этому методу через 15 минут составляет 40 (34-46), через 30 минут — 55 (49-61), через 45 минут — 58 (55-61), через 60 минут — 59 (56-62), через 24 часа — 65 (59-71), а у крупного рогатого скота — 2-4 деления за 24 часа.
Метод Панченкова.
РОЭ определяют в аппарате, состоящем из штатива и нескольких градуированных капилляров. Каждый капилляр градуирован от 0 до 100 делений, на уровне «0» (верхняя часть капилляра) нанесена метка «К» (кровь), а на уровне цифры «50» — метка «Р» (реактив). Объем градуированной части капилляра равен 100 мм3. Для постановки реакции капилляр смачивают 5%-ным раствором лимоннокислого натрия, а затем насасывают этот же раствор до метки «Р» и выдувают на часовое стекло. После этого тем же капилляром 2 раза набирают кровь до метки «К», каждый раз выдувая кровь на часовое стекло. Раствор и кровь на часовом стекле тщательно смешивают стеклянной палочкой, образовавшуюся смесь набирают в капилляр до метки «0». Капилляр устанавливают в штатив, учет высоты столба осевших эритроцитов ведут через 1 час и 24 часа.
В норме скорость оседания эритроцитов за один час по методу Панченкова колеблется в следующих пределах (в мм): у крупного рогатого скота — 0,5-1,5; овцы 0,5-1,0, козы — 0,3-1,0, верблюда — 1,0-4,0, лошади — 40,0-70,0, свиньи — 2,0-9,0, собаки — 2,0-6,0, лисицы серебристо-черной — 1,0-14,0, голубого песца — 1,0-5,0, норки — 1,0-3,0, соболя — 2,0-4,0, куницы- 2,0-4,0, кролика — 1,0-2,0, курицы — 2,0-3,0.
У молодых животных РОЭ более ускорена, чем у взрослых. Ускорение РОЭ наблюдается при многих лихорадочных инфекционных заболеваниях (инфекционная анемия, кровопятнистая болезнь, мыт, ангина и др.), лучевой болезни и т. д. Замедление РОЭ отмечается при механических илеусах и энцефаломиелите, желтухах, гастроэнтеритах, паралитической миоглобинурии лошадей и др.
Исследование химических свойств крови.
При исследовании химических свойств крови определяют: количество гемоглобина, билирубина, показатель резервной щелочности, количество в сыворотке крови общего белка, каротина, кальция и неорганического фосфора.
Определение количества гемоглобина (по Сали).
Количество гемоглобина определяют в гемометре ГС-2, состоящехм из колодки с тремя гнездами, градуированной пробирки, капиллярной и глазной пипеток. В двух крайних гнездах находятся или стандартные пробирочки, содержащие раствор солянокислого гематина, или стеклянные палочки соответствующего цвета. В среднее гнездо вставляют градуированную пробирку, имеющую две шкалы. Одна шкала (от 2 до 23) показывает количество гемоглобина в граммпроцентах (г%), а другая (от 10 до 140) — в процентах (в единицах гемометра); 10006 соответствует 16,67 г% гемоглобина.
В градуированную пробирку до метки «10» вносят глазной пипеткой 0,1 н. раствор соляной кислоты. Капиллярной пипеткой насасывают 20 мм 3 крови и осторожно выдувают ее в раствор кислоты. Затем этот раствор втягивают и выдувают обратно в пробирку несколько раз, чтобы смыть оставшуюся в пипетке кровь. Перемешивают и оставляют на 5 минут. В результате смешивания крови с соляной кислотой гемоглобин переходит в солянокислый гематин, раствор при этом приобретает коричневый цвет. Затем по каплям добавляют дистиллированную воду, постоянно помешивая до тех пор, пока цвет жидкости в пробирке не сравняется с цветом боковых стандартных пробирок. По делению шкалы, которое соответствует уровню раствора в пробирке, устанавливают количество гемоглобина.
Гиперхромемия — увеличение количества гемоглобина в крови — отмечается при поносах, рвоте, потливости, при образовании экссудатов и транссудатов.
Определение билирубина в сыворотке крови (по Ван-ден-Бергу).
В центрифужную пробирку берут 1 мл сыворотки крови к 2 мл спирта, смешивают и центрифугируют 20 минут. Затем к 1 лед прозрачного центрифугата прибавляют 0,5 мл спирта и 0,25 мл свежеприготовленной смеси диазореактивов Эрлиха (см. ниже). Окрасившуюся жидкость переносят в стаканчик колориметра и колориметрируют, сравнивая ее со стандартом, находящимся во втором стаканчике. Расчет производят по формуле:
где: С1 — количество билирубина (в мг%), С2 — концентрация стандартного раствора, Н1 — высота столба исследуемой жидкости (в мм), Н2 — высота столба стандарта (в мм), 5 — степень разведения сыворотки.
Смесь диазореактивов Эрлиха готовят из двух растворов:
1) сульфаниловая кислота — 0,2 г, соляная кислота (удельный, вес 1,19) З мл, дистиллированная вода — 200 мл;
2) азотнокислый натрий — 0,5 г, дистиллированная вода — 100 мл.
Оба раствора хранят в темной посуде. Для анализа приготовляют смесь двух растворов, для чего берут 10,0 мл первого раствора и 0,3 мл второго.
В качестве стандарта применяют раствор сернокислого кобальта (2,161 г предварительно высушенного реактива доводят дистиллированной водой до 100 мл), который хранят в темноте.
Для определения разновидностей билирубина и, следовательно, для дифференциации желтух применяют прямую и непрямую реакции.
Прямая реакция.
На 1 мл сыворотки крови наслаивают 0,5 мл смеси диазореактивов. Появление на границе жидкостей бордово-красного кольца указывает на наличие билирубина, проведенного через печень.
Положительная реакция всегда свидетельствует о патологии. Если кольцо появляется быстро, то это указывает на механическую желтуху, замедленная реакция отмечается при катаральной желтухе, циррозе печени, болезнях сердца.
Непрямая реакция.
К 1 мл сыворотки крови прибавляют 2 мл спирта, смешивают и центрифугируют. Затем 1 мл прозрачного центрифугата наслаивают в другой пробирке на смесь диазореактивов (1,5 мл). На границе жидкостей появляется цветное кольцо от розового до красно-фиолетового цвета. Положительная реакция зависит от наличия в сыворотке крови билирубина, не проведенного через печень. В норме эта разновидность билирубина обнаруживается у лошади. Повышенное содержание такого билирубина наблюдается при гемолитической желтухе.
В норме в сыворотке крови содержится билирубина у лошадей от 0,37 до 1,35 мг%, крупного рогатого скота — 0,01-0,30 мг%;
У других животных содержание билирубина в сыворотке очень незначительное (следы).
Определение резервной щелочности (по Неводову).
К 10 мл 0 01 н. раствора соляной кислоты прибавляют 0,2 мл крови, смешивают и титруют из микробюретки 0,1 н. раствором едкого натра до появления мути и выпадения хлопьев. Расчет производят по формуле:
где: х — резервная щелочность (в мг%),
а — количество миллилитров 0,1 н. раствора едкого натра, израсходованного на титрование.
Периодически для контроля к 10 мл 0,01 н. раствора соляной кислоты добавляют 1-2 капли 1%-ного спиртового раствора фенолфталеина и титруют 0,1 н. раствором едкого натра, до появления розовой окраски (нейтрализация). На титрование должен быть израсходован 1 мл раствора щелочи.
У животных в норме показатели щелочного резерва крови по Неводову составляют (в мг%): у крупного рогатого скота — 460-540, овцы — 460-520, козы — 380-520, верблюда 700-780, яка — 520-620, лошади — 470-620, лисицы серебристо-черной 340-500.
Ацидоз — снижение щелочного резерва — возникает в результате нарушения обмена веществ при белковом перекармливании, скармливании силоса, содержащего масляную кислоту, при атониях преджелудков, родильном парезе, ацетонемии, диабете, ящуре и других заболеваниях.
Алкалоз, или базеоз — повышение щелочного резерва — встречается редко и наблюдается главным образом при пироплазмозе и кровопятнистой болезни лошадей, селикозе, фибринозном воспалении легких, шоке.
Определение общего белка в сыворотке крови.
Общий белок определяют рефрактометрически, а белковые фракции — методом электрофореза на бумаге. Количество общего белка и соотношение белковых фракций в сыворотке крови здоровых животных приведены в табл. 37.
Определение каротина в сыворотке крови (по Ф. А. Рачевскому).
В пробирку вносят 0,2 мл свежей сыворотки крови, приливают
4 мл спирта (96°) и тщательно смешивают. Добавляют 2 мл петролеиного эфира или чистого бензина с температурой кипения ниже /о . Содержимое пробирки хорошо перемешивают и оставляют на несколько минут. Затем приливают по каплям 2 мл дистиллированной воды, в результате чего между спиртом и эфиром образуется поверхность раздела. Каротин находится в петролейном эфире бензине) и окрашивает верхний слой жидкости в желто-зеленоватыи цвет. Петролеиныи эфир с каротином насасывают в микропику и наливают его по каплям в фарфоровую чашечку, подогрело до 40 . После нанесения каждой капли ожидают полного высыхания её.
Для проверки результатов рекомендуется параллельно ставить такую же пробу со стандартным раствором каротина.
Содержание каротина в сыворотке крови вычисляют но формуле:
где: х — количество каротина (в мг%),
К — количество миллилитров эфирного (или бензинового) экстракта каротина, израсходованного на образование j желтого кольца.
В норме у крупного рогатого скота содержится в сыворотке крови от 0,5 до 3,0 мг% каротина, у кур — 0,3-0,5 мг%.
Определение кальция в сыворотке крови (по де-Ваарда).
В центрифужную пробирку (лучше с остроконечным дном) берут 1 мл сыворотки крови, прибавляют 0,5 мл насыщенного раствора щавелевокислого аммония, тщательно смешивают, оставляют на 30 минут, после чего жидкость центрифугируют 15 минут при 1,5-2 тыс. оборотов в минуту. Затем отсасывают жидкость над осадком пастеровской пипеткой с грушей (или сливают). К осадку добавляют 2 мл 2%-ного раствора аммиака, смешивают встряхиванием и центрифугируют 10 минут; промывание осадка повторяют еще два раза. В заключение отсасывают жидкость над осадком, к осадку добавляют 0,3 мл 50%-ного раствора серной кислоты, смешивают. Ставят пробирку в водяную баню при температуре 50-70° и выдерживают до растворения осадка, изредка помешивая жидкость стеклянной палочкой.
После растворения осадка жидкость титруют 0,01 н. раствором перманганата калия до появления бледно-розового окрашивавия, сохраняющегося не менее 1-2 минут.
Одновременно ставят «слепой» опыт. В пробирку берут вместо 1 мл сыворотки крови 1 мл дистиллированной воды, а все остальное производят таким же образом, как и в основном опыте.
Подсчет количества кальция производят по формуле:
х = 0,2-(а — б)*К*100,
Где: х — искомое количество кальция в сыворотке крови (в мг%)
а — количество миллилитров 0,01 н. раствора перманганата калия, израсходованного на титрование в основном опыте,
б — количество миллилитров 0,01 н. раствора перманганата калия, израсходованного на титрование в «слепом» опыте.
К — фактор к титру 0,01 н. раствора перманганата калия. В норме у животных количество кальция в сыворотке составляет (в мг %): у крупного рогатого скота — 9,5-12,5, овцы — 11-12,5, козы — 11,0-13,0, верблюда — 9,1-13,3, лошади — 12,0-16,0, свиньи — 11,5-12,5, собаки — 9,5-12,0, курицы — 170-22,0.
Гипокальцемия — уменьшение количества кальция в сыворотке крови — встречается при рахите, остеомаляции, нефрозе, родильном парезе, бронхопневмонии, экссудативном плеврите, анемии, лейкемии, диабете, остро протекающих тяжелых заболеваниях, хроническом сепсисе, тетании, недостаточности паращитовидных желез, лейшманиозе, контагиозной плевропневмонии, кровопятнистой болезни и др.
Гиперкальцемия — увеличение содержания кальция в сыворотке крови — наблюдается при остеомаляции, деформирующих артритах, гипервитаминозе, гиперпаратиреоидизме, сердечной недостаточности и т. д.
Определение неорганического фосфора в сыворотке крови (по Аммону и ГинсСергу).
В пробирку вносят 1 мл сыворотки крови, добавляют 3 мл дистиллированной воды и 1 мл 20%-ного раствора трихлоруксусной кислоты, хорошо смешивают и, дав постоять 10 минут, фильтруют через бумажный фильтр или центрифугируют.
Затем берут две широкие пробирки и в одну из них (опыт) вносят 2,5 мл фильтрата сыворотки, 0,5 мл раствора молибдена, 1 мл 1 %-ного раствора аскорбиновой кислоты и до 6 мл дистиллированной воды. В другую пробирку (стандарт) вливают 1 мл рабочего стандартного раствора фосфора, 1 мл дистиллированной воды, 0,5 мл 20°о-ного раствора трихлоруксусной кислоты, 0,5 мл раствора молибдена, 1 мл 1 %-ного раствора аскорбиновой кислоты и до 6 мл дистиллированной воды. Реактивы в обе пробирки следует вносить по возможности одновременно. Содержимое пробирок хометре размешивают и через 10 минут колориметрируют в колори.
Количество неорганического фосфора определяют по формуле:
Где; X искомое количество неорганического фосфора (в мг%),
H1 — высота столбика жидкости с фильтратом сыворотки крови (в мм),
H2 — высота столба жидкости со стандартным раствором фосфора (в мм).
Раствор молибдена готовят смешиванием двух растворов:
1) молибденовокислого аммония — 25 г, дистиллированной воды — 300 мл;
2) дистиллированной воды — 125 мл, концентрированной серной кислоты — 75 мл.
Рабочий стандартный раствор фосфора готовят из основного стандартного раствора фосфора. Для приготовления последнего (его готовят впрок) берут 4,388 г однозамещенного фосфорнокислого калия, предварительно высушенного в эксикаторе, и добавляют дистиллированной воды до 1 л. Хранят раствор в темной посуде с добавлением к нему 0,5 мл хлороформа.
Для приготовления рабочего стандартного раствора фосфора, что делают в день исследования, берут 1 мл основного раствора и добавляют к нему дистиллированной воды до 50 мл; в 1 мл рабочего раствора содержится 0,02 мг фосфора.
Для приготовления 1-ного раствора аскорбиновой кислоты необходимо взять 1 г аскорбиновой кислоты и добавить 0,1 н. раствора соляной кислоты до 100 мл. Раствор хранят в темной посуде, годен не более одного месяца.
В сыворотке крови животных в норме содержится неорганического фосфора (в мг%): у крупного рогатого скота 4,5-7,5, овцы — 7-8, козы — 6-8, верблюда — 5,1-6,7, лошади — 7-7,3,: свиньи — 5-6, собаки — 3-5,8, кошки — 6-8, кролика — 6-7.
Гипофосфатемия— уменьшение количества неорганического фосфора в сыворотке крови — наблюдается При рахите, остеомаляции, гиперпаратиреоидизме, сахарном диабете, недостатке витамина D.
Гиперфосфатемия — увеличение содержания неорганического фосфора — отмечается при гипервитаминозе D, заживлении переломов костей, нефрозах, гломерулонефритах, гипопаратирериДизме.
Подсчет форменных элементов крови у животных.
В клинической практике обычно определяют количество эритроцитов и лейкоцитов, а иногда и тромбоцитов.
Определение количества эритроцитов.
Подсчет количества эритроцитов производят в счетной камере с сеткой Горяева (камера Горяева). Кровь набирают в смеситель (меланжер) до метки «0,5», а затем до метки «101» насасывают жидкость-разбавитель, при этом кровь разбавляют в 200 раз. В качестве разбавителя применяют 0,9%-ный или 3%-ный раствор поваренной соли, жидкость Гайема (сулема — 0,5 г, хлористый натрий — 1 г, сернокислый натрий — 5 г, дистиллированная вода — 200 мл) или раствор йода (йод кристаллический — 0,3 г, йодистый калий — 0,4 г, лимоннокислый натрий — 2 г, дистиллированная вода — 100 мл).
Кровь с разбавителем тщательно перемешивают 2-3 минуты, удаляют 2-3 капли из капилляра меланжера, а следующую каплю наносят под заранее притертое покровное стекло на сетку камеры- Заряженную камеру закрепляют на предметном столике микроскопа и выжидают 2-3 минуты, чтобы эритроциты осели на дно. Для обнаружения сетки камеры пользуются объективом 8, а при подсчете эритроцитов применяют объектив 40. Подсчет начинают с левого большого квадрата (разделенного на 16 маленьких квадратиков), а затем подсчитывают эритроциты еще в 4 больших квадратах, расположенных по диагонали сеткикамеры.
Количество эритроцитов в 1 мм3 крови определяют по формуле:
где: х — искомое количество эритроцитов в 1 мм 3 крови,
а — сумма эритроцитов, подсчитанных в 5 больших квадратах,
б — степень разведения крови,
в — количество маленьких квадратиков в 5 больших квадратах,
4000 объем разбавленной крови над одним маленьким
квадратиком сетки камеры (в мм 3 ). При разведении крови (1 : 200) и подсчете эритроцитов в 5 больших квадратах формула значительно упрощается и будет выглядеть так:
х = а * 10 000.
Эритропения, или олигоцитемия, — уменьшение количества эритроцитов — характерна для первичных и вторичных анемий. Сопоставление числа эритроцитов с количеством гемоглобина позволяет делать важные дифференциально-диагностические заключения.
Эритроцитоз, или нолицитемия — увеличение числа эритроцитов — встречается при сгущении крови вследствие потери организмом воды при обильном потоотделении, поносах, во время образования экссудатов и транссудатов, в начальной стадии инфекционных и лихорадочных процессов, при непроходимости тонкого отдела кишечника.
Здоровых животных приведено в табл. 38.
Лейкоцитоз, или гиперлейкоцитоз — повышение количества лейкоцитов — встречается очень часто. Лейкоцитоз может быть:
1) физиологическим — при беременности, у новорожденных, после сильной физической нагрузки и т. д.; 2) медикаментозным — после введения белковых препаратов, алкалоидов, жаропонижающих средств и т. д., 3) патологическим — при инфекционных болезнях, воспалительных процессах, интоксикациях и др.
Лейкопения — понижение числа лейкоцитов — наблюдается при тяжелых инфекционных и токсических состояниях и свидетельствует об угнетении кроветворных органов или об их истощении.
Подсчет количества тромбоцитов (по Реес-Эккеру). В смеситель для лейкоцитов набирают до метки «0,5» консервирующую тромбоциты жидкость (лимоннокислый натрий — 3,8 г, 40%-ный формальдегид — 0,2 мл, бриллианткрезиловая синь — 0,1 г, дистиллированная вода — до 100 мл). Затем в смеситель до метки «1» набирают капиллярную кровь из уха и до метки «И» раствор Тюрка (для гемолиза эритроцитов) и хорошо размешивают (2- 10 минут). После этого заряжают счетную камеру, которую на 15-20 минут ставят в чашку Петри с комочком мокрой ваты на дне для ускорения оседания тромбоцитов.
Тромбоциты подсчитывают в 20 больших квадратах сетки (т. е. в 320 маленьких квадратиках). Определяют количество тромбоцитов в 1 мм 3 крови по формуле:
где: х — искомое количество тромбоцитов в 1 мм3 крови, а — количество подсчитанных клеток, б — степень разведения крови (в 20 раз), в — количество сосчитанных маленьких квадратиков (320),
1/4000 — объем разведенной крови в камере над одним маленьким квадратиком сетки (в мм 3 ). сокращенном виде формула выглядит так:
Тромбоцитоз — увеличение числа тромбоцитов — встречается при инфлюэнце лошадей, плеврите, миоглобинурии, саркоматозных поражениях и др.
Тромбоцитопения — уменьшение количества тромбоцитов — наблюдается при инфекционной анемии лошадей, кровопятнистой болезни, стахиботриотоксикозе.
Подсчет форменных элементов крови у птиц.
Техника подсчета кровяных клеток у птиц несколько затруднена. Это объясняется тем, что у них как эритроциты, так и тромбоции — формы и имеют ядра, поэтому в обычных условиях не дифференцируются. Эти кровяные клетки не разрушаются уксусной кислотой, что препятствует определению числа лейкоцитов. В связи с этим при подсчете форменных элементов крови у птиц вначале в счетной камере подсчитывают общее количество клеток (эритроцитов, лейкоцитов и тромбоцитов), а затем в окрашенном мазке каждые 1000 эритроцитов устанавливают число лейкоцитов и тромбоцитов. В заключение перерасчетом определяют абсолютное количество отдельных видов клеток в 1 мм 3 крови.
Определить количество клеток в крови у птиц можно также прямым способом в камере Горяева, для чего применяют раствор с красителями. По К. С. Фоминой и В. И. Шмельковой, берут 0,1%-ный раствор азура на изотоническом растворе поваренной соли (раствор можно использовать в течение месяца). Кровь разводят в большом меланжере в соотношении 1 : 100 теплым раствором азура (38-40°). Немедленно после заполнения меланжера проиводят тщательное размешивание Крови встряхиванием кровомесителя. Через 10-15 минут заряжают камеру. Эритроциты подсчитывают в 5 больших квадратах, лейкоциты и тромбоция определяют по всей сетке камеры (225 больших квадратов)Я Вычисление количества кровяных клеток производят по обычным формулам.
Определение лейкоцитарной формулы.
Лейкоцитарную формулу определяют в окрашенных мазках крови.
Приготовление мазков крови. Мазки готовят на чистых обезжиренных предметных стеклах.
Хороший мазок доля;ен быть тонким, равномерным (несколько уже предметного стекла), длинным (не менее 2/3 стекла) и иметь свободные концы.
Фиксация мазков. Мазки высушивают па воздухе фиксируют в метиловом спирте 3-5 минут или используют другие фиксаторы: этиловый спирт — 20 минут, смесь эфира со спиртом поровну — 20 минут, ацетон — 5 минут.I
Окраска мазков. Мазки окрашивают красками, растворенными в нейтральной дистиллированной воде. Для определения реакции воды применяют следующий метод. 50 мл воды,в химический стаканчик, добавляют одну каплю 0,2%-ного раствора. При кислой реакции вода окрашивается в красно-фиолетовый, при нейтральной — в бледно-розовый, а прощелочной — в желтовато-соломенный цвет. Усредняют кислую воду 1%-ным раствором двууглекислой соды, а щелочную 1%-ным раствором уксусной кислоты.
Указанные растворы добавляют по каплям к окрашенной индикатором воде до появления темно-розового цвета. Затем вычисляют количество усредняющего створа на больший объем дистиллированной воды. Раскраску мазков производят по Романовскому-Гимза. Для этого помещают над чашкой на стеклянные палочки мазком вверх, наливают на них раствор краски Романовского — Гимза (на 1 мл нейтральной дистиллированной воды берут 1-2 капли краски) и красят 20-35 минут в зависимости от температуры окружающего воздуха. Можно также мазки положить в чашку Петри на спички (мазком вниз) и подлить под них краску. Затем мазок промывают дистиллированной водой и высушивают на воздухе. Правильно окрашенный мазок должен иметь розовато-фиолетовый оттенок.
Мазки можно окрашивать и без предварительной фиксации их. Для этого на высушенный мазок наносят 20 (30) капель спиртового раствора краски Романовского -Гимза (на 20 мл спирта берут 5 мл краски). Через 5 минут И краске добавляют 20 (30) капель дистиллированной воды и продолжают окрашивать еще 20-25 минут. Краску смывают водопроводной водой. Мазки сушат на воздухе.
Техника выведения лейкоцитарной формулы.
Лейкоцитарная формула выражает процентное соотношение отдельных форм лейкоцитов. В норме она слагается из соотношения базофилов, эозинофилов, нейтрофилов (юных, палочко ядерных и сегменто ядерных), лимфоцитов, моноцитов (табл. 39).
Для определения лейкоцитарной формулы в окрашенном мазке крови обычно подсчитывают 200 лейкоцитов. Количество клеток каждой формы лейкоцитов делят на 2, получая процентное выражение.
При подсчете лейкоцитов используют метод Шиллинга. Для этого на препарате выбирают 4 участка — два в начальной и два в конечной его части. В каждом участке отыскивают под иммерсионной системой микроскопа край мазка, подсчитывают здесь лейкоциты и передвигают препарат вглубь последовательно еще на 3 поля зрения. Затем смещают мазок на одно поле в сторону и возвращаются снова к краю препарата. Такие смещения мазка производят до тех пор, пока не будет подсчитано 50 лейкоцитов на одном участке. После этого находят таким же образом по 50 лейкоцитов на каждом другом участке мазка. Всего должно быть подсчитано 200 лейкоцитов.
Регистрацию отдельных форм лейкоцитов осуществляют или на специальном одиннадцати клавишном счетчике или в таблице Егорова.
Определение лейкоцитарного профиля.
Для более точного и полного суждения об изменениях в лейкоцитарном составе крови необходимо определить лейкоцитарный профиль, который выражает абсолютное содержание отдельных форм лейкоцитов в 1 мм3 крови. С этой целью подсчитывают общее количество лейкоцитов
в 1 мм 3 крови и выводят лейкоцитарную формулу. Затем количество лейкоцитов умножают последовательно на процент каждого вида клеток лейкоцитарной формулы и делят на 100.
В лейкоцитарной формуле при различных заболеваниях могут происходить следующие основные изменения:
1) увеличение или уменьшение процента тех или иных клеток — нейтрофилия или нейтропения (резкая нейтропения называется агранулоцитозом), лимфоцитоз или лимфопения, эозинофилия или эозинопения, моноцитоз или моноцитопения, базофилия;
2) появление молодых незрелых форм (юные, миелоциты и даже промиелоциты);
3) появление дегенеративных изменений в лейкоцитах — токсической зернистости и вакуолей в протоплазме, пикноза, лизиса, вакуолизации или полисегментации ядра, появление гигантских форм нейтрофилов.
Наиболее частым и практически самым важным является нейтрофильный лейкоцитоз. При этом лейкоцитозе наблюдается увеличение количества (повышение процента) незрелых нейтрофильных клеток в периферической крови, что именуется «сдвигом (ядра) влево», так как при записи лейкоцитарной формулы молодые клетки принято ставить слева от зрелых нейтрофилов.
По степени регенерации нейтрофильный лейкоцитоз разделяют на следующие три группы:
1) нейтрофилия с простым регенеративным сдвигом — количество палочкоядерных нейтрофилов возрастает не более чем на 13% при нормальном или несколько уменьшенном количестве сегментоядерных;
2) нейтрофилия с резким регенеративным (гиперрегенеративным) сдвигом — появляются юные, миелоциты и даже промиелоциты;
3) нейтрофилия с дегенеративным сдвигом — уменьшается количество сегментоядерных нейтрофилов, появляются атипичные клетки с дегенеративным ядром и протоплазмой, «сдвиг влево» углубляется за счет палочкоядерных, но без дальнейшего увеличения процента более молодых форм.
Определение качественных изменений клеток крови.
Исследование мазков крови, кроме определения лейкоцитарной формулы и лейкоцитарного профиля, позволяет также установить наличие тех или иных морфологических изменений эритроцитов и лейкоцитов, включая появление ядерных форм эритроцитов. В специально окрашенных мазках можно определить количество гранулоцитов (ретикулоцитов), т. е. эритроцитов с зернистой субстанцией. По количеству таких форм эритроцитов можно судить о степени регенерации крови.
источник

Для того чтобы как можно раньше выявить какие-либо отклонения в работе организма бурёнки, необходимо сдавать биохимический анализ крови.
Анализ проводится для того, чтобы выявить у животного нарушения обмена веществ, недостаток каких-либо полезных веществ в организме. С помощью этой процедуры можно вовремя заметить развитие лейкоза, определить, каким именно инфекционным заболеванием заразилось животное.
Кровь разносит по организму все полезные вещества, витамины и минералы. От того, насколько правильно и быстро осуществляется кровоток, зависит не только общее состояние животного, но и количество получаемого молока.
Способов взять кровь у скота существует три. Они заключаются в получении образцов из яремной, молочной, хвостовой вены. Их нужно брать исключительно новой и стерильной иглой. Животное обязательно следует фиксировать в неподвижном положении, чтобы оно не травмировало само себя, не перевернуло пробирку. Перед процедурой нужно выстригать шерсть в области, где будет сделан укол, дезинфицировать поверхность раствором фенола, йодом или спиртом. На пробирке с образцом должен присутствовать порядковый номер коровы. Ёмкость ни в коем случае нельзя трясти.
Взятие крови из яремной вены является самым распространённым способом. Рекомендуется проводить процедуру рано утром, перед первой кормлением. Чтобы провести анализ нужно привязать голову бурёнки, зафиксировать её в неподвижном состоянии. Далее следует зажать вену в нижней трети шеи, потом вводить иглу под острым углом. Кончик иглы должен быть направлен к голове животного.
Плюсами такого способа являются:
- животное почти не травмируется;
- лёгкость произведения операции;
- быстрота проведения процедуры.
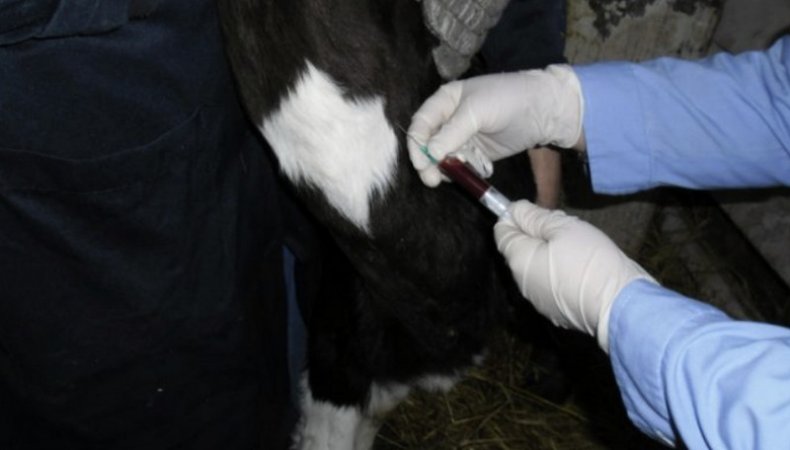
- сильное разбрызгивание крови;
- появление риска распространения инфекций, которые опасны не только для животных, но и для человека;
- сложность фиксации коровы в определённом положении;
- частое возникновение осложнений, которые проявляются в виде абсцессов, гематом;
- стресс у коровы, который может привести к снижению удоя.
Забор образца из молочной вены происходит только у взрослых коров. Упомянутые вены находятся сбоку от вымени, тянутся по брюху снизу. Они снабжают молочную железу кровью и необходимыми питательными веществами. Чем лучше развиты вены, тем больше молока даёт бурёнка. 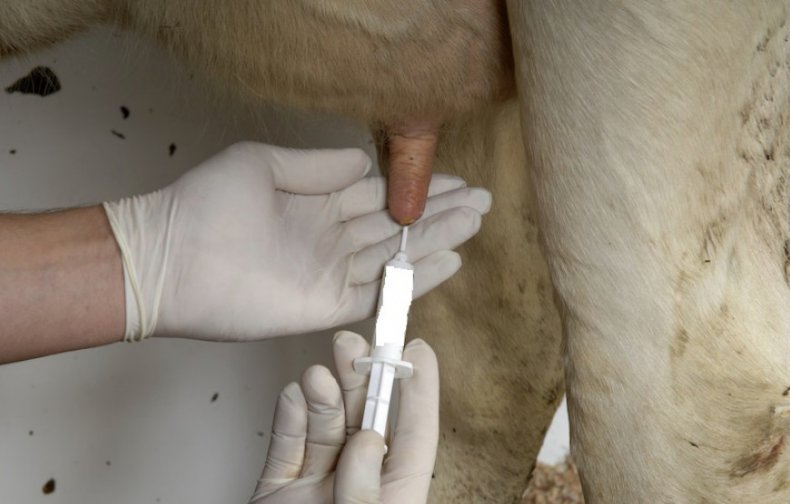
Положительными сторонами данного метода являются:
- доступная цена материалов, необходимых для проведения процедуры;
- высокая скорость сбора образца;
- меньшее разбрызгивание, чем при взятии образца из яремной вены.
Минусов у такого способа значительно больше, чем плюсов:
- высокий риск травмировать животное;
- контакт с кровью коровы;
- во время процедуры тёлка испытывает огромный стресс, потому что забор образца проводится в очень нежной зоне, которую животное постоянно оберегает;
- сложность проведения процедуры.
Данный способ получения образца крови у крупного рогатого скота устарел. Благодаря новым технологиям, методам и оборудованию такую процедуру проводят гораздо быстрее и легче, минимизируя риски для животного.
Из хвостовой вены брать образец наиболее безопасно. Сейчас всё более популярным становится использование вакуумных систем — это специально сконструированные пробирки, в которых уже присутствует нужный антикоагулянт и снижено давление, чтобы кровь плавно вытекала в ёмкость. 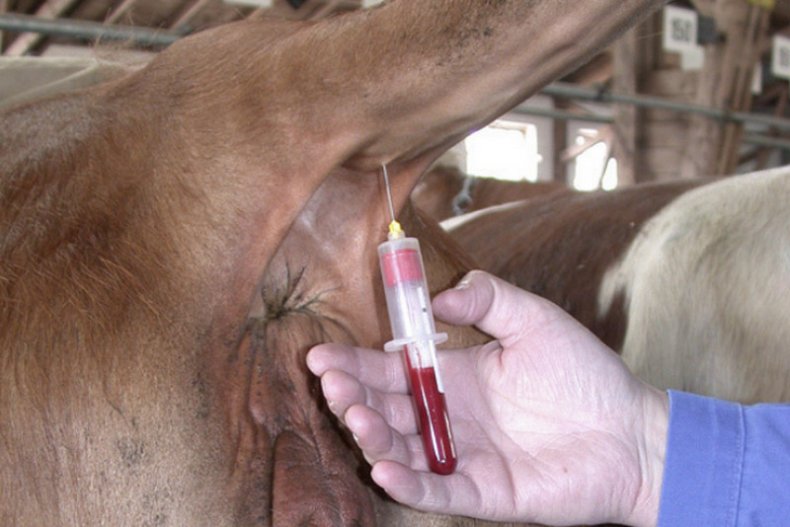
Из явных положительных сторон этого метода можно выделить:
- полученный образец стерилен;
- риск образования сгустков в пробирке значительно снижен;
- не требуется фиксировать животное;
- очень высокая скорость проведения процедуры. Один ветеринар может за час взять до двух сотен образцов;
- крайне малый шанс возникновения побочных эффектов или травм у коровы;
- исключение непосредственного контакта с кровью;
- корова не испытывает стресса и привычный удой сохраняется.

- более высокая стоимость оборудования;
- низкая популярность упомянутого метода.
При проведении биохимического анализа крови выделяют несколько основных показателей, которые являются наиболее важными при ведении молочного и мясного хозяйства. Чтобы лучше понимать, как должны выглядеть идеальные анализы, следует знать таблицу норм:
источник
В настоящее время интенсивные технологии в животноводстве занимают ведущее значение. Процесс эффективного молочного и мясного производства все стремительней отдаляет условия содержания животных от их естественной среды обитания. Сегодня уже смело можно сказать, что чем выше продуктивность животных, тем больше сбоев и срывов происходит из-за нарушения обмена веществ, в связи с особым значением кормления и содержания. Поэтому все без исключения специалисты животноводства должны участвовать в процессе не только производства продукции, но и создания комфортных условий пребывания животных на ферме.
Высокая продуктивность животных неразрывно связана с активизацией функционирования всех органов и систем организма. При этом уровень обмена веществ у некоторых животных настолько высок, что организм может работать на самоуничтожение. К сожалению, многие руководители хозяйств, специалисты-зооинженеры, ветеринарные врачи и даже ряд ученых этим пренебрегают. В наиболее распространенном понимании это выглядит так: «Животное имеет достаточно высокую продуктивность при имеющемся кормлении, качестве обслуживания и обработках– значит все нормально. Нужно еще поискать резервы экономии ресурсов». В результате таких настроений многие не могут понять, почему при погоне за удоем стремительно сокращается поголовье, почему коровы заканчивают третью лактацию на мясокомбинате с жировой дистрофией печени и т.д.
В большинстве случаев мы замечаем отклонения в здоровье, когда уже есть симптомы заболевания, а, значит, негативный фактор был, он оставил свой след в организме и, теперь, выдает ответную реакцию организма на его воздействие. Другими словами мы пропускаем, минимум два периода развития процесса – проникновение и распространение в организме. Разрабатывая наши рекомендации, надеемся, что вы, регулярно пользуясь биохимическими исследованиями крови, сможете на ранних стадиях неблагоприятного влияния своевременно отреагировать, классифицировать и принять меры к устранению воздействия.
Кровь является одной из главнейших связующих систем целостного организма. Она обеспечивает питание и дыхание всех органов и тканей, снабжает их необходимыми ферментами, гормонами, медиаторами и другими гуморальными веществами, без которых нормальное функционирование организма невозможно. У здоровых животных при нормальных физиологических условиях существует постоянство химико-морфологического состава и физико-химических свойств крови. Кроветворные органы чувствительно реагируют на различные физиологические и, в особенности на патологические, воздействия на организм изменением картины крови. Поэтому исследование крови имеет большое диагностическое значение.
Конечно, нужно заметить, что определенную ценность биохимические показатели имеют при внутренних незаразных болезнях, интоксикациях, но в большей степени отражают уровень кормления и обменные процессы. В связи с этим биохимические показатели не могут дать ответы на все вопросы, но при правильном понимании физиологических изменений становятся твердым основанием для принятия производственных решений.
ОТБОР И ПОДГОТОВКА ПРОБ КРОВИ
Для того чтобы провести биохимическое исследование необходимо правильно произвести отбор крови у животных.
Существует несколько вариантов взятия крови. Многие специалисты успешно их используют. Мы же остановимся на классическом (традиционном) способе.
У крупных животных кровь берут из яремной вены, расположенной в яремном желобе. Предварительно проводят антисептическую обработку – в месте вкола шерсть выстригают, поверхность кожи обрабатывают 70%-ным раствором спирта или 5% раствором йода.
Для взятия используют специальные инъекционные иглы заранее стерилизованные. Вкол проводят под углом 45 0 и во время набора крови иглу прижимают к стенке пробирки, чтобы избежать вспенивания.
Метод взятия крови у овец и коз такой же как и у коров.
У свиней кровь получают, отсекая кончик хвоста. У поросят оптимальным местом для взятия служит полая вена.
У птицы кровь берут из разреза гребня или сережек. У гусей и уток пункцию берут из мякоти ступней лапок.
Пробирки для отбора проб крови на исследования специалисты хозяйств могут получать в ветеринарной лаборатории или заранее готовить в условиях хозяйства, если такая возможность имеется.
Во время подготовки специальной посуды на одно животное запасают по 2 биологических пробирки, объемом не менее 20 мл, и по 2 центрифужных пробирки объемом 12 мл. В первую биологическую пробирку (20 мл) вносят 1%-ный раствор гепарина 2-3 капли или, если не определяется натрий в плазме крови, то для стабилизации используют лимоннокислый натрий. В результате полученную плазму можно исследовать на калий, натрий, каротин, витамины А и С.
Вторую пробирку оставляют без изменений, так как в ней будут получать сыворотку крови. В сыворотке крови определяют содержание общего белка, белковых фракций, мочевины, общих липидов, общего холестерина, общего кальция, йода неорганического, активность щелочной фосфатазы и др.
В одну из центрифужных пробирок вносят 0,5 мл вазелинового масла и каплю 1%-ного гепарина. После длительного центрифугирования 20-30 мин. уже в плазме определяют резервную щелочность. Во вторую центрифужную пробирку вносят 5 мл 20%-ного раствора трихлоруксусной кислоты. В дальнейшем из этой пробирки определяют глюкозу, неорганический фосфор и неорганический магний.
Для всех пробирок используются резиновые пробки, но в некоторых случаях допускаются пробки из ватных тампонов завернутых в марлевую повязку, при обязательном условии стерилизации и вертикальной транспортировки проб.
Таким образом, уже сама подготовка пробирок для взятия крови животных на исследование является трудоемкой и длительной. Поэтому в последнее время ее значительно упростили. Например, для биохимического исследования отбирают по 2⁄3 20 мл пробирки, а для гематологического и того меньше. В первую очередь это связано с разработкой в научно-исследовательских институтах специальных диагностикумов для определения биохимических компонентов с более мягкими требованиями пробоподготовки. Но и не последнее место занимает, конечно, сама точность и направление исследований. Если в каких то реакциях вам не нужны сотые и тысячные доли (не научные исследования) или вы уделяете большее внимание, каким то конкретным показателям, то, естественно, лучше упростить процедуру отбора.
БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ
Каротин является провитамином ретинола – витамина А. Содержится в растительных кормах, молозиве, рыбьем жире. Наибольшее значение имеет β-каротин. В тонком кишечнике и печени β-каротин превращается в витамин А. Основное депо каротина и витамина А – печень.
Витамин А способствует биосинтезу холестерина, ускоряет обмен фосфорных соединений, участвует в обмене веществ, повышает реактивность и резистентность, участвует в процессах иммуногенеза, повышении фагоцитарной активности лейкоцитов и выработке антител, стимулирует рост и развитие животных.
Количество каротина в сыворотке крови определяют спектрофотометрическим методом.
Принцип метода основан на щелочном гидролизе и экстракции витамина А и каротина из плазмы крови при помощи малолетучих растворителей и последующем спектрофотометрическом измерении поглощения света раствором при длине волны 328 нм для витамина А и 460 нм для каротина.
Материал для исследования – плазма крови.
Физиологические пределы: Содержание каротина в сыворотке крови повышается в летний период и снижается в зимне-стойловый период. Уровень каротина в сыворотке крови свидетельствует о величине поступления его в организм с кормами. Усвоение его и превращение в витамин А зависит от интенсивности обменных процессов в организме.
Количество каротина в сыворотке крови животных
источник
Источник: справочные материалы из книги «Практическое пособие: корова и телёнок», авторы др. З.Кальхройтер и др.Фридрих Штамп. Перевод Елены Бабенко специально для проекта soft-agro.com
| Параметр | Единица измерения | |||
| мг/дл | ммоль/л | |||
| Кальций | 9.5-10.5 | 2.4-2.6 | ||
| Неорганический фосфор, лактация | 6.0-6.5 | 2.0-2.2 | ||
| Неорганический фосфор, сухостойная корова и телка | 6.5-7.5 | 2.2-2.5 | ||
| Магний | 2.5-3.5 | 0.8-1.3 | ||
| Глюкоза | 55-75 | 3.0-4.0 | ||
| Холестерин | 100-190 | |||
| Натрий | 135-155 | |||
| Калий | 3.5-5.0 | |||
| Определить содержание натрия и калия более достоверно можно с помощью анализа слюны или мочи | ||||
| Бета-каротин | >500 мкг/дл | |||
| Оптически с помощью центрифуги, сыворотка янтарно-желтого цвета (цветовая шкала >8) | ||||
| Микроэлементы | мкг/дл | |||
| Медь | 90-120 | |||
| Цинк | 95-130 | |||
| Марганец | >1.0 | |||
| Железо | >140 | |||
| Селен | 40-70 мкг/л сыворотки | |||
| Витамин В12 | 0.25-0.35 мкг/л | |||
| Обмен веществ и ферменты | ||||
| Мочевина | 20-35 мг/дл | |||
| Бетагидроксимасляная кислота (кетоз) | С нетерпением жду отзывы и комментарии. Большое Вам спасибо! | |||
Спасибо Елена, на практике зачастую встречается снижение
содержания кальция при повышенном уровне фосфора, не могли ли Вы
интерпретировать такую картину.
С уважением В.Шириев
Добрый день! Все хорошо, но данные параметры должны быть дифференцированы по группам кормления: сухостой, новотёл, раздой и производство должны быть различными.
Норма для коровы в диких условиях одна, а при промышленном скотоводстве она будет всегда ниже. Потому нет резона делать исследования крови, так как мы всегда будем не дотягивать до нормы. Нужны нижние границы нормы. В таблице нет «вилки».
Хочется понимать как биохимию привязывать к рациону?
Хотя бы дефицит микроэлементов. На сколько чего надо увеличить, чтобы получить норму?
Есть мнение, что биохимия резко меняется, если брать кровь в разное время. Как быть в этом случае?
Елена, спасибо, очень важная публикация.
На сегодняшний день нет четко установленных показателей, устанавливающих границы физиологической нормы, поэтому кто-то пользуется справочниками Васильевой, кто-то данными Сорочинской или справочником Досона, а многие исследователи просто из интернета — кто чего найдёт. Более того, многие до сих пор не перешли на единицы измерения системы СИ. Мы исследуем кровь по 18 показателям, данные практически совпадают с представленными в Вашей статье, хотя некоторые границы у нас более широкие, а по магнию, например, у вас представлены более широко. Так, СА мы ставим 2,1-3,8, Р- 1,4-2,5, магний — 0,7-1,2 ммоль/л. глюкозу — 2,3-4,1 ммоль/л. Хочется отметить, что в настоящее время очень актуально исследование лактата ( эфира молочной кислоты), так как можно заметить начало лактатного ацидоза и принять соответствующие меры. Планируем систематизировать данные, полученные за 10 лет работы, выработать более четкие нормы для голштинизированного скота в нашей зоне.
спасибо за важную информацию
Добрый день Елена, спасибо за полезную информацию.
Сталкивался с примерно таким же материалом на немецком языке, где анализ крови молочного крупного рогатого скота идет с интерпритацией полученных результатов, т.е. как по изменению состава крови в ту или иную сторону можно примерно диагностировать отклонение «нарушение» в кормлении или в состояние здоровья животного. Имеется ли у Вас такая информация на русском языке, не смогли бы ей поделится.
Меня интересует подобная информация по крови для промышленного свиноводства в разрезе по разным половозрастным группам животным (супоросные, лактирующие свиноматки, молодняк на опоросе, доросте и откорме) не собираетесь ли подготовить переводной материал и по этой теме.
Дмитрий, здравствуйте, сбросьте мне на емейл ссылку этого материала, я посмотрю.
источник
Минжасов К.И., Мухаметова В.Д., Аубакирова А.К. Биохимический скрининг крови коров с нарушениями воспроизводительной функции
В живом организме кровь играет первостепенную роль, выполняя транспортную, трофическую функции, доставляет к клеткам органов тела питательные вещества и кислород, удаляет продукты обмена и углекислоту.
Через кровь обеспечиваются гормональная регуляция защитных функций, равновесие электролитов в организме [1].
Необходимым условием нормального существования организма, его органов и тканей является постоянство состава крови – гомеостаз.
Различные нарушения жизнедеятельности органов и тканей влияют на состав крови, а изменение состава крови, в свою очередь, отражается на жизнедеятельности органов и тканей.
Кровь черезвычайно тонко реагирует на различные потологические процессы, происходящие в организме, и нередко по изменению количества и составных элементов крови можно определить характер патологического процесса [2].
Таким образом, разностороннее исследование биохимического состава крови имеет большое диагностическое значение, поскольку помогает специалисту грамотно и достоверно определить общее состояние организма животного, объяснить корреляцию между показателями, прогнозировать исход заболевания, корректировать терапию, изучать влияние тех или иных лекарственных средств.
Проведя акушерско-гинекологическую диспансеризацию маточного поголовья в трех базовых хозяйствах: ТОО «Ульгули», ТОО «Северо-Казахстанская сельскохозяйственная опытная станция», ТОО «Зенченко и К» при общем поголовье животных – 615 голов, были отобраны в опыт коровы с нарушениями воспроизводительной функции (длительное отсутствие послеродовых половых циклов, больные эндометритами, маститами и др.) по 60 голов с каждого хозяйства.
В трех хозяйствах проводили взятие проб крови (60 голов×3 хозяйства = 180 проб) у животных с нарушением воспроизводительной функции и маститами.
Хозяйства условно разделили по группам: I группа – ТОО «Ульгули», II группа – ТОО «Северо-Казахстанская сельскохозяйственная опытная станция», III группа – ТОО «Зенченко и К».
Результаты проведенных исследований оценки состояния белкового, фосфорно-кальциевого, витаминного обменов, кислотно-щелочного равновесия, функций печени представлены в таблице 1.
Из таблицы 1 видно явное отклонение некоторых биохимических показателей крови от норматива.
В частности, содержание общего белка в крови больных животных было завышено, а во второй и третьей группах гораздо выше верхней границы нормы на 7 г/л и 26,5 г/л, соответственно, достигнув уровня 93,0 и 112,5 г/л, при норме 75,0 г/л.
Гиперпротеинемию можно объяснить наличием в организме очага воспаления, в результате активации иммунологического процесса и повышенного образования иммуноглобулинов.
Альбумин – одна из фракций белка, при снижении уровня может указывать на поражения печени и наличие инфекционных процессов в организме.
По результатам наших биохимических тестов показатель альбумина в трех группах был в пределах физиологической нормы (27,5-52,4 г/л): в I группе – 30,5 г/л, во II – 38,4 г/л, в III группе– 49,2 г/л.
В организме, в котором протекает воспалительный процесс, происходит уменьшение уровня кальция, что служит предпосылкой ослаблению родовых сил, нарушению кислотно-щелочного равновесия в организме.
В наших исследованиях уровень кальция был ниже нижней границы нормы 9,5 мг% во всех хозяйствах, группах: в I группе достиг – 6,8 мг%, во II – 5,4 мг%, в III группе– 8,8 мг%.
Показатель фосфора был в пределах нормы 2,0 ммоль/л во всех группах: в I группе достиг – 1,8 ммоль/л, во II – 1,6 ммоль/л, в III – 2,13 ммоль/л.
Щелочная фосфатаза – фермент, образующийся в костной ткани, печени, слизистой оболочке кишечника, плаценте, легких.
Повышение активности щелочной фосфатазы указывает на ослабление воспроизводительной функции коров и свидетельствует о половых нарушениях.
Результаты наших тестов подтверждают данные, уровень фосфатазы был значительно завышен во II группе – 145,6 МЕ/л, в III – 139,3 МЕ/л, против средней нормы 85,0 МЕ/л. В первой группе показатель был в пределах нормы – 40,4 МЕ/л.
Обмен веществ состоит из совокупности множества химических реакций, протекающих в организме.
Течение этих реакций осуществляется с помощью биологических катализаторов-ферментов, одним из которых является класс трансфераз, катализирующих реакции гидролитического расщепления внутримолекулярных связей.
Повышение активности аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) в сыворотке крови наблюдается при заболеваниях, связанных с разрушением клеток, заболеваниях печени, почечных некрозах.
В наших исследованиях отмечено резкое увеличение АЛТ на фоне сниженного уровня АСТ. Это является ярким подтверждением наличия процесса нагноение в органах половой системы самок.
При этом максимальное увеличение активности АЛТ, при норме 66,0 МЕ/л, на 23 % отмечено у животных II группы, достиг уровня 81,3 МЕ/л и на 39 % в III группе, достиг уровня – 92,1 МЕ/л.
В первой группе показатель АЛТ был в пределах нормы – 41,4 МЕ/л. Активность АСТ была снижена в I группе на 71 % – 28,4 МЕ/л, во II на 71,6 %– 27,5 МЕ/л, в III группе на 20 % – 78,0 МЕ/л.
Таблица 1 – Биохимические показатели крови коров с нарушениями воспроизводительной функции
| Показатель крови | Норма | I группа -ТОО «Ульгули»(n = 60), М±m | II группа – ТОО «Северо-Казахстанская сельскохозяйственная опытная станция» (n= 60), М±m | III группа-ТОО «Зенченко и К» (n= 60), М±m | |||||||||||||||||||||||||||
| 7560,0-86,0 | 70,2±3,4 | 93,0±2,7 | 112,5±2,1 | ||||||||||||||||||||||||||||
| Альбумин, г/л | 39,027,5-52,4 | 30,5±0,5 | 38,4±0,3 | 49,2±0,3 | |||||||||||||||||||||||||||
| Кальций, мг% | 11,09,5-12,5 | 6,8±1,0 | 5,4±1,4 | 8,8±0,6 | |||||||||||||||||||||||||||
| Неорганический фосфор, ммоль/л | 2,01,4-2,5 | 1,8±0,8 | 1,6±0,6 | 2,13±0,3 | |||||||||||||||||||||||||||
| Щелочная фосфатаза, МЕ/л | 85,017,5-152,7 | 40,4±2,5 | 145,6±1,8 | 139,3±2,3 | |||||||||||||||||||||||||||
| АСТ, МЕ/л | 97,085,0-100,0 | 28,4±3,5 | 27,5±4,6 | 78,0±4,7 | |||||||||||||||||||||||||||
| АЛТ, МЕ/л | 66,038,0-75,0 | 41,4±2,6 | 81,3±2,2 | 92,1±2,8 | |||||||||||||||||||||||||||
| Холестерин, ммоль/л | 2,01,6-5,0 | 4,0±1,6 | 4,2±1,4 | 4,8±1,3 | |||||||||||||||||||||||||||
| Мочевая кислота, мколь/л | 47,010,5-83,5 | 134,0±0,2 | 135,0±0,5 | 128,2±0,4 | |||||||||||||||||||||||||||
| Глюкоза, ммоль/л | 3,22,3-4,1 | 2,02±2,6 | 1,8±3,1 | 3,0±3,0 | |||||||||||||||||||||||||||
| Витамин А, мкг% | 52,024,0-80,0 | 16,8±1,3 | 20,9±1,2 | 25,8±1,3 | |||||||||||||||||||||||||||
| Примечания:1 Р Витамин А является одним из главных среди показателей нарушений воспроизводительной функции коров, так как его снижение неминуемо влечет к снижению общей резистентности, задержанию последа, субинволюции матки, абортам, эндометритам, снижению синтеза гормонов. Уровень витамина А был ниже нижней границы нормы (24,0 мкг%) и составил в I группе – 16,8 мкг%, во II – 20,9 мкг%, в III группе – 25,8 мкг%. Таким образом, при биохимических исследованиях проб крови коров с заболеваниями половой сферы выявили нарушение белкового, фосфорно-кальциевого, витаминного обменов, кислотно-щелочного равновесия, функций печени. Биохимия крови выявила протеинемию (в среднем до 91,9 г/л), гипокальцемию (на 36,6 % до 7,0 мг%), повышение щелочной фосфатазы (на 28,0 % до 108,4 МЕ/л в среднем), увеличение активности АЛТ (на 9 % до 71,6 МЕ/л), гиперурикемию, повышение уровня мочевой кислоты (на 32 % до 132,4 мкмоль/л), гиповитаминоз А (снижен на 41 % до 21,2 мкг%)
В общем, полученные результаты биохимических исследований крови крупного рогатого скота с заболеваниями репродуктивных органов позволят дифференцировать заболевания, могут служить подспорьем врачу-клиницисту при расшифровке того или иного патологического состояния, облегчить постановку диагноза, дать общую оценку состояния организма и судить о силе воздействия болезнетворного агента. Исследуемый материал: сыворотка или плазма. Взятие: Натощак, обязательно перед проведением диагностических или лечебных процедур. Кровь берется в сухую, чистую пробирку (желательно одноразовую). Используют иглу с большим просветом (без шприца, исключения только при трудных венах). Кровь должна стекать по стенке пробирки. Плавно перемешать, плотно закрыть. Сдавливание сосуда во время взятия крови должно быть минимальным. Хранение: Сыворотка или плазма должны быть отделены как можно быстрее. Хранится материал в зависимости от требуемых для исследования показателей от 30 минут (при комн. температуре) до нескольких недель в замороженном виде (размораживать пробу можно только 1 раз). ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕЗУЛЬТАТЫ – при долгом сдавливании сосуда повышаются при исследовании концентрации белков, липидов, билирубина, кальция, калия, активности ферментов, – плазму нельзя использовать для определения калия, натрия, кальция, фосфора и т.д., – следует учитывать, что концентрация некоторых показателей в сыворотке и плазме различна Концентрация в сыворотке больше, чем в плазме: альбумин, ЩФ, глюкоза, мочевая кислота, натрий, ОБ, ТГ, амилаза Концентрация в сыворотке равна плазме: АЛТ, билирубин, кальций, КФК, мочевина Концентрация в сыворотке меньше, чем в плазме: АСТ, калий, ЛДГ, фосфор – гемолизированная сыворотка и плазма не пригодна для определения ЛДГ, Железа, АСТ, АЛТ, калия, магния, креатинина, билирубина и др. при комнатной температуре через 10 минут отмечается тенденция к снижению концентрации глюкозы, – высокие концентрации билирубина, липемия и мутность проб завышают значения холестерина, – билирубин всех фракций снижается на 30-50%, если сыворотка или плазма подвергаются воздействию прямого дневного света 1-2 часа, – физические нагрузки, голодание, ожирение, прием пищи, травмы, операции, внутримышечные инъекции вызывают повышение ряд ферментов (АСТ, АЛТ, ЛДГ, КФК), – следует учитывать, что у молодых животных активность ЛДГ, ЩФ, амилазы выше, чем у взрослых. Норма: Кошки: 5-11 ммоль/л Собаки: 3-8.5 ммоль/л, Преренальные факторы: обезвоживание, усиление катаболизма, гипертиреоз, кровотечение в кишечнике, некроз, гипоадренокортицизм, Ренальные факторы: заболевание почек, нефрокальциноз, неоплазия. Постренальные факторы: конкременты, неоплазия, заболевание простаты. – нарушение функции почек – непроходимость мочевыводящих путей – повышенное содержание белка в пище – повышенное разрушение белка (ожоги, острый инфаркт миокарда) Снижение – белковое голодание – избыточное потребление белка (беременность, акромегалия) – нарушение всасывания – после введения глюкозы, – при повышенном диурезе, – при печеночной недостаточности. КРЕАТИНИН – конечный продукт метаболизма креатина,синтезируемого в почках и печени из трех аминокислот(аргинина,глицина,метионина).Полностью выделяется из организма почками путем клубочковой фильтрации,не реабсорбируясь в почечных канальцах. Норма: Кошки: 40-130 мкм/л Собаки: 30-170 мкм/л Повышение – нарушение функции почек(почечная недостаточность) – гипертиреоз -мышечная дистрофия Снижение – беременность – возрастные уменьшения мышечной массы – угроза рака или цирроза Пропорция – Отношение мочевина/креатинин (0,08 и меньше) позволяет прогнозировать скорость развития почечной недостаточности. АЛТ Фермент, вырабатываемый клетками печени, скелетных мышц и сердца. Норма: Кошки: 8,3-52,5 ЕД/л Собаки: 8-57 ЕД/л Повышение – разрушение клеток печени (некроз, цирроз, желтуха, опухоли ) – разрушение мышечной ткани (травма, миозит, мышечная дистрофия) – ожоги – токсическое действие на печень лекарств (антибиотиков и др) Пропорция – АСТ/АЛТ > 1 – возможна патология сердца или мышечной ткани; АСТ/АЛТ http://zoohelp.ru/item/50-biokhimicheskij-analiz-krovi Чтобы оценить состояние здоровья коров, у них берут анализы: мочу и кровь. У ветеринара есть предписание, делать это регулярно, чтобы предупредить или выявить заболевания КРС. Исследованию подвергаются все животные в стаде. Биохимический анализ крови выявляет нарушение обмена веществ у коров, развитие лейкоза, инфекционные заболевания. Анализируя результаты, назначается определённое лечение или даются рекомендации по изменению рациона питания. Кровь у коровы берут из ярёмной вены. Она проходит в области шеи. Перед забором крови животное не кормят, не дают воды. Корову фиксируют, чтобы она не сломала иглу шприца. В лаборатории проводят биохимический анализ:
С помощью биохимического анализа крови коровы определяют уровень свободных жиров и микроэлементов. Если показатели не соответствуют норме, то у КРС диагностируют нарушение метаболического процесса. Это явление приводит к костным заболеваниям, сердечно-сосудистым нарушениям, аномальным проявлениям в мягких тканях. Уровень свободных жиров в норме – до 15,0 %. Если жиров выявлено больше, то это указывает на ожирение общего организма или отдельных внутренних органов. Корова может оставаться с нормальным весом, но сердце, печень или почки покрываются жировым слоем. Это проводит к дисфункции органов. При нормальном уровне минеральных веществ у коровы в крови устанавливаются следующие показатели (мг):
Количество электролитов измеряется в ммоль/л:
Чтобы подтвердить анализ крови, берут на исследование мочу и молоко у коровы. Недостаток каротина чаще всего бывает у молодняка. Нехватка витамина влияет на развитие костей, органов зрения, функции слизистых. Показатель не одинаков при различных условиях содержания животных. Установлено, что лейкоз или лейкемия, относится к вирусным заболеваниям. Чаще всего вирус охватывает особей 4-7 лет. При развитии заболевания происходит изменение структуры крови. Это приводит к образованию злокачественных опухолей внутренних органов организма. При анализе крови на лейкоз обнаруживается повышенный уровень лейкоцитов, поэтому ещё одно название заболевания – белокровие. Показатель достигает 9 тыс. клеток на 1 мкл крови. Вирус в организм животного попадает через ЖКТ, слизистые, через сперму при оплодотворении, через молозиво. Если поражённое животное не было выявлено и находилось вместе со стадом, то риск заражения других особей максимален. В организм телёнка вирус попадает с молозивом. На ферме объявляется карантин. Начало развития заболевания распознать трудно. Уровень лейкоцитов в крови может соответствовать норме.
Заболевание переходит в хроническую стадию. Инкубационный период затяжной, до 2 лет. Ветеринары по установленному графику обязательно проводят анализ на реакцию иммунодиффузии (РИД). Он призван установить наличие вируса в крови. Анализ показывает резкое повышение уровня лейкоцитов, изменение в клетках: их недоразвитость. Обязательно берут на исследование сперму и молоко. К внешним признакам лейкоза относится нехарактерное поведения животного и ухудшение качества молока. Одни специалисты утверждают, что молоко и мясо коровы с лейкемией на ранней стадии, можно употреблять в пищу. Необходима лишь термическая обработка продуктов. Другие говорят, что для человека опасно даже кипячёное молоко и варёное мясо, если они были произведены больной коровой. При дальнейшем развитии белокровия у животного отмечаются изменения в ЖКТ. Корова становится малоактивной, страдает несварением кишечника, повышенным газообразованием, запором или диареей. В каловых массах появляются кровяные сгустки. При терминальной стадии лейкемии кровь перестаёт выполнять свою функцию. Иммунная система не работает. Животное не может противостоять вирусу. Оно погибает. Если телёнок заразился лейкозом от кормилицы, то он умирает через 2 недели.
Против лейкемии КРС рекомендуют прививать вакцину. Она проводится в 2 этапа. На первом этапе вводятся препараты 6-меркаптурин, циклофосфамид. Для второго этапа применяют метотраксат. Вакцины вводят с промежутком в 3 дня. Способ введения сложный эндолюмбальный. Иглу вводят в спинной мозг. Процедуру рекомендуют проводить в специальном помещении. Недопустимо вакцинировать КРС от лейкоза в условиях коровника или в открытых загонах. Ветобслуживание КРС 2 раза в год анализ крови и прививки Изучены особенности адаптации коров красно-пестрой голштино-фризской породы к воздействию низких температур разного диапазона при холодном беспривязно-боксовом способе содержания в климатических условиях Центрально-Черноземного района России. Установлено, что температурные воздействия -5 0С и -20 0С вызывают в организме коров изменения углеводного, белкового и липидного обменов, мобилизацию энергетических резервов организма, нарушение функции печени и желудочно-кишечного тракта, что подтверждается достоверными изменениями в содержании глюкозы, общего белка, креатинина, мочевины, билирубина, холестерина, ферментов АлАТ, АсАТ в сыворотке крови. При этом выраженность изменений биохимических параметров достоверно выше при воздействии более низкой температуры, а их характер может указывать на развитие стресс-реакции и срочную мобилизацию энергетических резервов организма для преодоления стрессорного воздействия. холодный метод содержания.биохимические параметры крови 1. Абатчикова М. Г., Костеша Н. Я. Физиологические механизмы адаптации при холодном методе выращивания телят. 2. Авылов Ч. Стресс-факторы и резистентность животных // Животноводство России. – 2000. – № 11. – С. 20-21. 3. Бусловская Л. К. Энергетический обмен и кислотно-щелочной баланс у сельскохозяйственных животных при адаптации к стрессорам / Л. К. Бусловская. – Белгород: Изд-во БелГУ, 2003. – 188 с. 4. Василисин В. В., Соколов В. В., Голубцов А. В. Физиолого-биохимические показатели крови коров красно-пестрой породы и коров симментальской породы австрийской селекции // Вестник Воронеж. гос. аграр. ун-та. – 2009. – №1 (20). – С.58-63. 5. Горизонтов П. Д. Стресс и система крови. – М.: Медицина, 1983. – 240 с. 6. Громыко Е. В. Оценка состояния коров методами биохимии // Экологический вестник Северного Кавказа. – 2005. – № 2. – С. 80-94. 7. Донник И. М., Шкуратова И. А. Особенности адаптации крупного рогатого скота к неблагоприятным экологическим факторам окружающей среды // Ветеринария Кубани. – 2009. – № 5. – С. 16-17. 8. Кудрин М., Ижболдина С. Роль микроклимата в продуктивности коров // Молочное скотоводство. – 2011 (август). – С. 33-34. 9. Кушнерова Н. Ф., Спрыгин В. Г., Фоменко С. Е. Влияние стресса на состояние липидного и углеводного обмена печени, профилактика // Гигиена и санитария. – 2005. – № 5. – С. 17 – 21. Интенсификация молочного животноводства и перевод его на промышленную основу предъявляют повышенные требования к состоянию крупного рогатого скота. В настоящее время в условиях средней полосы России широко применяется холодный метод содержания молочного поголовья, при котором практикуется содержание скота с первых дней жизни без регуляции параметров микроклимата, что идет вразрез с климатическими особенностями наших регионов. По действующим требованиям к микроклимату коровников они должны быть оборудованы системами вентиляции и отопления, чтобы обеспечить в помещениях температуру 10 0С и относительную влажность не выше 75 %. Эти нормативные параметры необходимо поддерживать в течение всего периода эксплуатации животных. Т.е. «холодное содержание» действует в нарушение этих норм. Несоответствие факторов микроклимата физиологическим потребностям организма вызывает систематические функциональные нарушения, предрасполагающие к развитию таких заболеваний как маститы, копытная гниль и т. д. В связи с этим важным является изучение беспривязно-боксового холодного способа содержания коров, характеризующегося наиболее широким спектром стрессирующих факторов [9; 10]. Высокопродуктивные животные, обладая интенсивным обменом веществ и энергии, склонны к нарушениям гомеостаза, сохранение которого сопровождается напряжением компенсаторных механизмов. Величина энергозатрат на приспособление к неблагоприятным условиям, так называемая «цена адаптации», при этом возрастает. Для сельскохозяйственных животных это выражается в непроизводительном расходовании кормов и снижении продуктивности. Анализ биохимических параметров крови позволяет судить о состоянии углеводного, белкового, липидного обменов, выявить непродуктивные энергозатраты организма [1; 3; 5; 6]. Цель работы – изучить биохимические параметры крови коров при воздействии отрицательных температур разного диапазона, в условиях беспривязно-боксового холодного способа содержания. Материал и методы исследования Экспериментальная часть работы была выполнена в условиях молочно-товарной фермы «Петровка – 1» Белгородского района, где содержится 150 голов коров красно-пестрой голштино-фризской породы. В хозяйстве применяется холодный беспривязно-боксовый способ содержания. Исследование особенностей адаптации коров к воздействию низких температур осуществлялось в двух сериях эксперимента: в первой – изучали адаптацию коров к воздействию температуры -5 0С, во второй: -20 0С, поголовье контрольной группы содержалось при температурных условиях +15 0С. Забор крови производился из яремной вены в одно время при одинаковых внешних условиях до утреннего кормления.
Результаты собственных исследований и их обсуждение Показатели крови являются индикатором работы всего организма, они могут характеризовать уровень адаптации животных к различным стрессирующим факторам, в том числе и к конкретным условиям содержания [6]. В табл. 1 представлены биохимические показатели крови коров при воздействии температуры -5 0С. Таблица 1. Биохимические показатели крови коров при воздействии температуры -5 0С
Примечание: достоверные изменения по сравнению с контрольной группой (гр. №1)* – при Р Ю.А. Корчагина – лаборант отдела лабораторных исследований службы технологического консультирования ГОАУ ЯО «Информационно-консультационная служба» Исследованиями установлена положительная корреляция удоя и содержания белка в молоке с активностью ферментов крови АЛТ и АСТ. Наибольшее содержание жира и белка – в молоке коров ярославской породы. Молочная продуктивность обуславливается согласованной напряженной работой всего организма коровы. Исследования ряда авторов показывают, что для образования 1 л молока необходимо, чтобы через молочную железу коровы проходило 400-500 л крови. Все компоненты молока образуются из крови, которая поступает в молочную железу. Однако состав крови и молока существенно различаются. Так, сахара в молоке в 90 раз больше, чем в крови, жира – в 9 раз, кальция в 13, фосфора – в 10 раз. В то же время белка в нем вдвое, а натрия в 7 раз меньше, чем в крови. Белки молока образуются в вымени, как в результате фильтрации определенных составных частей молока из кровеносного русла, так и синтеза компонентов молока в процессе клеточного обмена в альвеолах. Казеин, лактоальбумин, лактоглобулин молока синтезируются из аминокислот, доставляемых с кровью, в молочной железе. Таким образом, для 80-90% белков молока, предшественниками являются свободные аминокислоты крови. Остальные 10-20% белков молока, то есть иммунные глобулины и сывороточные альбумины, являются идентичными этим белкам в крови, так как проникают в молоко из крови в неизменном виде путем диффузии (Богатова О.В., Догарева Н.Г., 2004). Кровь в организме играет исключительно важную роль, поскольку через нее осуществляется обмен веществ. Она доставляет к клеткам органов тела питательные вещества и кислород, удаляя продукты обмена и углекислоту. По данным биохимических показателей крови можно судить об интенсивности обменных процессов, следовательно, об уровне молочной продуктивности животных. Г.А. Бондаренко (1983) предлагает использовать метаболиты крови в качестве дополнительных тестов в селекции, направленной на повышение молочной продуктивности крупного рогатого скота, путем выявления и последующего разведения животных, метаболический уровень которых свойственен коровам с высокими показателями молочной продуктивности. Исследования связи между показателями молочной продуктивности и биохимическими показателями крови имеют научную новизну, в доступной литературе данных не имеется.
Использование их в селекционной работе позволит повысить молочную продуктивность коров. Поскольку ферменты крови, их активность, уровень обмена веществ, а также биохимическая адаптация закодированы в наследственности животных, в их генах, то можно полагать, что биохимический состав крови у животных в определенной мере связан с их племенными и продуктивными качествами. Среди различных ферментов, связанных с обменом аминокислот и белков, особый интерес представляют аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ). В ЗАО СП «Меленковский» нами было отобрано 30 полновозрастных коров с учетом возраста, продуктивности и живой массы. Из них сформировано 3 группы по принципу пар-аналогов по 10 голов соответственно ярославской, голштинской пород и улучшенного ярославского скота с кровностью по голштину от 3,1 до 87,5%. Исследование биохимических показателей крови проводили в весенне-летний период общепринятыми методамис использованием современного полуавтоматического биохимического анализатора «Vitalon-400», рассчитанного на минимальное использование сыворотки крови (до 1 мл). Кровь для исследования отбирали до утреннего кормления из яремной вены у коров, не имеющих признаков травматического ретикулита, мастита, эндометрита и других заболеваний, которые могут оказать влияние на биохимические показатели. Определение общего белка в сыворотке крови проводилось биуретовым методом, разработанного в 1949 году Горналлом, Бардавиллом и Дэвидом, а ферментов аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) – оптимизированным энзиматическим кинетическим методом. В настоящее время данные методы усовершенствованы российской компанией «Витал Диагностик Спб» и позволяют достичь высокой точности результатов. Методы исследования: общезоотехнические с биометрической обработкой материалов по Е.К. Меркурьевой (1977); определены средняя биометрическая М, ее ошибка m, коэффициент корреляции r. В таблице 1 приведены основные показатели биохимического анализа крови.Таблица 1 – Биохимические показатели у лактирующих полновозрастных коров ярославской, голштинской пород скота и улучшенных генотипов (n=30) УЛУЧШЕННЫЙ ТИП ЯРОСЛАВСКОГО СКОТА У лактирующих полновозрастных коров ярославской породы в изученный период отмечено повышенное, в сравнении с голштинскими и улучшенными сверстницами, содержание общего белка крови в среднем на 4,3 г/л и 4,9 %. Но при этом у них же была выявлена пониженная, в сравнении с коровами голштинской породы, активность ферментов переаминирования – АСТ, АЛТ на 32,3 ед/л и 24,6 %; на 4,9 ед/л и 15 % и повышенная, по сравнению с помесями, активность ферментов аминотрансфераз на 12,4 ед/л и 12,5 %; на 2,6 ед/л и 9,2 % соответственно. Это, в определенной степени, указывает на более напряженный обмен белков и усиленное их использование животными ярославской породы. По-видимому, генетически обусловленные особенности белкового обмена обеспечивают лучший качественный состав молока у этих животных – большее содержание белка (3,63 %) при достаточно высокой жирности (4,07 %). У коров голштинской породы при высоких удоях (7114,5 кг) резко возрастают обменные процессы всех систем. У них выявлена повышенная по сравнению с указанными породами активность ферментов АЛТ и АСТ в среднем на 6,23 ед/л и 18,8 %; на 38,43 ед/л и 29,3 % соответственно. Таким образом, ферменты сыворотки крови (АЛТ и АСТ) связаны с уровнем молочной продуктивности и породной принадлежностью животных и, следовательно, могут служить интерьерным ориентиром при углубленной селекции высокопродуктивного молочного скота. Прогнозирование молочной продуктивности с использованием показателей крови, как указывают Е.В. Эйдригевич, В.В. Раевская (1978), требует особенно четких представлений о биосинтезе компонентов молока, их предшественниках и факторах, контролирующих молокообразование. Лактация – очень сложный процесс, и секреция молока в молочной железе всего лишь заключительный его этап. Вначале в ряде внутренних органов –желудке, кишечнике, печени и других – происходит образование предшественников молока.
Учитывая важность сопряженности селекционных признаков в теоретическом и практическом плане, рассчитаны коэффициенты корреляции между отдельными продуктивными признаками у лактирующих полновозрастных коров ярославской, голштинской пород скота и улучшенных генотипов. Установлена ярко выраженная отрицательная корреляционная связь между удоем за 305 дней лактации и содержанием белка во всех изученных породах (r от -0,23 до -0,81). Положительная связь между удоем и содержанием жира отмечена у голштинской породы (r=0,25) и улучшенного типа ярославского скота (r=0,14). Полученные материалы показывают, что с увеличением удоев коров голштинской породы и голштинизированных ярославок имеется слабая тенденция к увеличению процента жира и к снижению белка в молоке. При этом получена высокая положительная связь междукачественными показателями молока у голштинской (r=0,71) и ярославской (r=0,69) породами, что позволяет эффективно проводить отбор животных по одному из признаков, не снижая уровень второго. Таким образом, увеличивая содержание белка в молоке, можно получать больше продуктов (сыра, творога) за счет увеличения казеина в молоке и при этом не снижая в них массовое содержание жира. Принимая во внимание перспективы использования биохимических показателей крови в селекционно-племенной работе, следует отметить, что природа корреляций между компонентами крови и признаками продуктивности животных основана на твердо установленных фактах, определяющих роль генов в синтезе белков (Патрушев Л.И., 2002). Продуктивность животных всегда связана с усилением отдельных направлений обмена веществ, и в этом отношении значительный интерес представляют ферменты крови. Другим подходом для успешного ведения племенной работы и совершенствования существующих пород и раннего прогнозирования будущей продуктивности молочного скота необходимо изучение взаимосвязи между величиной молочной продуктивности и биохимическими показателями крови, так как они имеют непосредственное отношение к процессам молокообразования. С целью поиска взаимосвязи между показателями белкового обмена, молочной продуктивностью и ее основными компонентами определены коэффициенты корреляции. Установлено, что между общим белком сыворотки крови и показателем массовой доли жира в молоке у коров разных пород проявлялась отрицательная связь. Наиболее высокая обратная связь оказалась у коров голштинской породы (r=-0,32), самая низкая наблюдалась у коров ярославской породы (r=-0,06). Средняя положительная коррелятивная связь найдена между белком крови и белком молока уголштинизированного скота (г=0,47). Выявлена положительная связь между активностью ферментов переаминирования (АЛТ и АСТ) и удоем у улучшенного типа ярославского скота. Наиболее значимая высокая зависимость проявлялась в группе ярославской породы между активностью АсАт и удоем и содержанием белка на уровне +0,24 и +0,33 соответственно, активностью АлАт и содержанием белка на уровне +0,38. Обобщая полученные данные по выявлению связи, как между признаками молочной продуктивности, так и их сопряженности с биохимическими показателями крови, пришли к заключению, что общей закономерностью:
Таким образом, можно прогнозировать, что отбор животных с высоким удоем и содержанием белка в молоке будет способствовать как повышению жирномолочности, так и белкового обмена. источник |



