Множественная миелома — это злокачественное заболевание плазматических клеток (плазмоцитов), являющихся конечным продуктом дифференцировки B-лимфоцита.
Плазмоциты — основные клетки в организме, которые отвечают за продукцию антител (иммуноглобулинов), защищающие его от инфекций.
Как осуществляется диагностика множественной миеломы? Какие лабораторные анализы и методы инструментального обследования назначают врачи при данной патологии?
Злокачественные клетки миеломы оккупируют костный мозг и вытесняют нормальные клетки.
Обычно плазмоциты продуцируются по мере необходимости. Когда организм сталкиваются с болезнетворными бактериями или вирусом, некоторые B-лимфоциты созревают до плазматических клеток, которые начинают вырабатывать антитела. Небольшое количество плазмоцитов содержится в костном мозге, лимфоидной ткани (например, в лимфоузлах) и дыхательных путях.
Когда плазматическая клетка перерождается в злокачественную, она начинает бесконтрольно делиться, создавая многочисленное число копий — клонов, которые формируют в костном мозге опухоли. Бесконтрольно размножаясь, злокачественные клетки вытесняют нормальные клетки костного мозга. Также эти новообразования разрушают кость, появляются литические поражения костной ткани — характерный клинический признак миеломы.
В зависимости от количества присутствующих опухолей, заболевание подразделяют на:
- солитарную плазмоцитому — одиночная опухоль образуется в кости или в другом органе,
- множественную миелому — в кости возникает более одной опухоли и в других органах.
Поскольку злокачественные плазмоциты при миеломе клонируются из одной и той же клетки, все они продуцируют одинаковые антитела, называемые аномальными моноклональными иммуноглобулинами (М-протеин), которые выявляются в крови, а иногда и в моче.
Выделяют 5 классов иммуноглобулинов: IgG, IgA, IgM, IgD и IgE. Каждый из них состоит из четырех белковых цепей — двух одинаковых тяжелых (длинных) и двух одинаковых легких (более коротких).
- Существует пять отдельных типов тяжелых цепей, различающихся аминокислотными последовательностями, которые соответствуют своему классу иммуноглобулина: гамма — IgG, мю — IgM, альфа — IgA, дельта — IgD и эпсилон — IgE.
- И два типа легких цепей, которые общие для всех классов иммуноглобулинов, называемые каппа и лямбда.
Внутри плазматической клетки две тяжелые цепи одного типа и две легкие цепи также одного типа формируют молекулу иммуноглобулина. Миеломная клетка синтезирует только один класс иммуноглобулина.
Y-образные синего цвета иммуноглобулины представляют собой M-протеин.
У пациентов с множественной миеломой злокачественные клетки продуцируют только один класс иммуноглобулина в больших количествах и / или продуцируют в избытке только одну из легких цепей или редко тяжелую цепь. Эти одинаковые иммуноглобулины или легкие цепи называются моноклональным белком (а также М-протеин, миеломным белком, парапротеином, или пиком протеина).
Выделяют несколько вариантов миелом, каждый из которых соответствует классу иммуноглобулина или легкой цепи.
- Иммуноглобулин-продуцирующие миеломы — чаще всего встречаются IgG и IgA-миеломы, вариант IgG встречается в 60% случаев, а на IgA-миелому приходится около 20%. Варианты IgE и IgD-миеломы встречаются редко.
- Продуцирующие легкие цепи миеломы — вариант, при котором производится чрезмерное количество только легких цепей. На него приходится до 20% случаев. М-протеин, который обнаруживается при данном варианте, называют протеин Бенс-Джонса. Этот белок в большом количестве попадает в кровоток. Из-за того, что это относительно небольшая молекула, белок свободно фильтруется почками. Поэтому в крови его выявляют в малых количествах, а в моче — много.
Мониторинг моноклональных антител — важный компонент эффективного лечения при меланоме.
Лабораторные исследования назначаются при меланоме для того, чтобы диагностировать заболевание, определить его тяжесть и распространение, выявлять осложнения по мере их возникновения и контролировать эффективность лечения.
Нет ни одного анализа, который мог бы “в одиночку установить” диагноз. При постановке диагноза врач руководствуется субъективными жалобами больного, анамнезом (история болезни), осмотром больного, результатами лабораторных анализов и / или методов медицинской визуализации (компьютерная томография, МРТ и др.).
Врач может заподозрить множественную миелому по характерным изменениям для данного заболевания в биохимическом и общем анализе крови.
- Увеличение общего белка.
- Повышение уровня кальция.
- Лейкопения (низкое содержание белый кровяных телец) или эритропения (низкое содержание эритроцитов).
- Умеренное или значительное повышение количества протеина в моче.
Такие результаты анализов позволяют заподозрить болезнь, но не являются диагностическими для миеломы, поскольку аналогичные изменения наблюдаются и при других заболеваниях. Они указывают на необходимость проведение дальнейшего диагностического поиска. Для этого врач назначает следующие лабораторные тесты:
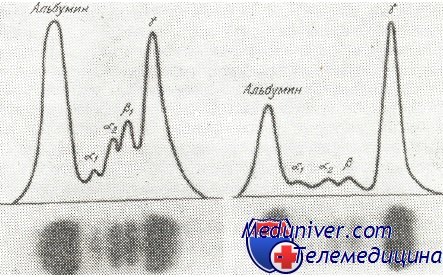
- Электрофорез белков сыворотки и иммунофиксация. Анализ используется при постановке диагноза, а также для контроля течения болезни. Он позволяет выявить моноклональные парапротеины в сыворотке и других биологических жидкостях. С помощью электрофореза белки разделяют на фракции в зависимости от их электрического заряда и размера. У большинства людей (до 80%) с множественной миеломой большое количество аномального иммуноглобулина приводит к появлению М-градиента на протеинограмме, также известного как пик М. Также может значительно уменьшаться количество нормальных иммуноглобулинов. Электрофорез с иммунофиксацией проводится для идентификации конкретного типа белка, который вырабатывается злокачественными клетками. Количество этого белка может меняться в течении болезни, но его тип останется неизменным.
- Определение легкой цепи (протеина Бенс-Джонса) в моче. У некоторых людей с множественной миеломой определяется данным протеин в моче. Как правило, исследование предусматривает 24-часовой сбор мочи. Определение легкой цепи (каппа и лямбда) помогает при постановке диагноза, а также оценить эффективность проводимого лечения.
- Свободные легкие цепи иммуноглобулинов в сыворотке крови. Тест измеряет количество свободных легких цепей в крови. Даже у здорового человека (по неизвестным причинам) плазматические клетки вырабатывают избыток легких цепей по сравнению с тяжелыми, и это приводит к тому, что небольшое количество из них не участвует в формировании иммуноглобулинов. Они остаются свободными легкими цепями и попадают в кровоток. У людей с множественной миеломой наблюдается чрезмерное производство либо каппа, либо лямбда легких цепей. Определение отношения каппа и лямбда легких цепей является чувствительным индикатором этого заболевания. Анализ используется при постановки диагноза, а также для выявления прогрессирования заболевания и определения эффективности проводимого лечения.
- Количественное определение иммуноглобулинов. Анализ определяет количество разных классов иммуноглобулинов. Анализ на IgG, IgA и IgM назначают при постановки диагноза и с целью мониторинга болезни. Обратите внимание, что тест не определяет аномальный иммуноглобулин, вырабатываемый клетками миеломы.
- Аспирационная или трепан-биопсия костного мозга. Множественная миелома — болезнь костного мозга. Без проведения этого анализа невозможно определить, сколько злокачественных плазматических клеток присутствует в костном мозге, и оценить, как они влияют на развитие нормальных лейкоцитов, эритроцитов и тромбоцитов.
- Цитогенетический анализ. Исследование включает кариотипирование и флуоресцентную гибридизацию in situ (FISH), клетки оценивают под микроскопом с целью поиска аномальных хромосом. Аномалии, такие как транслокация хромосом (перенос участка хромосомы на негомологичную хромосому) или делеция (потеря участка хромосомы), наблюдаются при множественной миеломе. Обнаружение этих аномалий дает возможность спрогнозировать течение заболевания.
Как правило, следующие лабораторные анализы назначаются при постановки диагноза, а также для отслеживания течения заболевания и выявление осложнений:
Комплексная метаболическая панель, группа тестов, используемых для оценки функции почек и других органов, состояния электролитного баланса, определения уровня кальция, альбумина и общего белка.
- Развернутый анализ крови, с помощью его оценивают клеточный состав крови (лейкоциты, эритроциты и тромбоциты) и определяют степень тяжести анемии (измеряют гемоглобин).
- Содержания в крови мочевой кислоты. Повышение ее уровня указывает на неблагоприятное течение заболевания.
- Бета-2-микроглобулин, белок расположенный на поверхности плазматических клеток; повышение уровня может указывать на ухудшение прогноза; этот анализ используется при постановке диагноза.
- Вязкость сыворотки крови определяется по отношению к вязкости воды, и зависит от содержания белков в плазме крови; когда уровни аномального белка становятся очень высокими, вязкость сыворотки увеличиваться, появляется симптоматика «густой крови».
- Рентгенологическое исследование костей помогают оценить стадию процесса и проводить мониторинг течения заболевания. С помощью обычного рентгена выявляют очаги литического повреждения кости, определять их размеры, он помогает прогнозировать угрозу возникновения патологического перелома.
- МРТ (магнитно-резонансная томография) считается более информативной, чем обычные рентгеновские снимки при оценке разрушения кости.
- КТ (компьютерная томография) / ПЭТ (позитронно-эмиссионная томография) использоваться для поиска опухолей в случае, если в результате обычного рентгенологического исследования костных поражений не были выявлены при наличии болевого синдрома.
Стадирование помогает прогнозировать течение заболевания, разработать индивидуальный план мониторинга и лечения. Для этого используют следующие параметры:
- Количество аномального иммуноглобулина.
- Содержание кальция в крови.
- Степень и тяжесть повреждения костей.
- Степень тяжести анемии.
Существуют различные системы стадирование множественной миеломы, позволяющие оценить количество присутствующей опухолевой массы и дисфункцию органов. Анализ на бета-2 микроглобулина и содержание альбумина в крови, особенно важны при постановке диагноза миеломы.
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.
источник
Миеломная болезнь (множественная миелома) — это злокачественное иммунопролиферативное заболевание системы крови, выражающееся в образовании опухоли из лимфоцитов, продуцирующих антитела. Преимущественно процесс затрагивает костный мозг. Страдают от него чаще всего люди после 40 лет, особенно пожилые мужчины. Ежегодно болезнь диагностируется у 0,003−0,005% населения.
Что инициирует развитие болезни, точно неизвестно. Есть лишь данные, что её частоту увеличивает ионизирующая радиация.
Патологический процесс начинается с опухолевой трансформации полипотентной стволовой клетки. При этом наблюдаются множественные хромосомные нарушения. Однако болезнь никак не проявляет себя на протяжении 20—30 лет (поэтому случаи её диагностики в возрасте до 40 лет редки).
За это время получившая новые свойства клетка прорастает в костную ткань и почки, в организме появляется многоочаговая опухоль. Она локализуется в основном в позвоночнике и плоских костях черепа, рёбер и таза, инициирует остеолизис и остеопороз. Кальций из разрушенных костей попадает в кровь и оседает в виде плотных образований в выделительных органах — почках, лёгких, слизистой желудка.
Миеломная болезнь проходит несколько стадий развития, за время которых опухоль набирает массу. Идентифицировать их можно следующим образом:
- I стадия (малая масса). Концентрация гемоглобина в эритроцитах превышает 100 г/л. Патологического парапротеина класса lgG содержится менее 5% или иммуноглобулина класса lgA менее 3%. Концентрация микроглобулина бета-2 менее 3,5 мг/л, а альбумина 3,5 г/дл или более. Уровень ионов кальция нормальный. Отсутствуют клинические и рентгенологические изменения костей либо есть одиночная плазмоцитома или остеопороз. Больной может жить на этой стадии долгие годы без лечения.
- II стадия (средняя масса). Гемоглобин снижается до 85—100 г/л. Парапротеин lgG или lgA возрастает до 5—7 или 3—5%, соответственно. Микроглобулина бета-2 становится 3,58−5,5 мг/л. Уровень кальция незначительно повышается. Наблюдаются начальные рентгенологические изменения костей.
- III стадия (большая масса). Гемоглобин падает ниже 85 г/л. До 7 и 5%, соответственно, повышаются lgG и lgA. Микроглобулина бета-2 не менее 5,5 мг/л. Уровень кальция выше 2,75 ммоль/л. Выражено три или более клинических проявления поражения костей, остеолизис. Продолжительность жизни на этой стадии не превышает 2—3 лет.
Из-за размножения плазматических клеток и выработки моноклональных антител появляются симптомы миеломной болезни. Клиническая картина выглядит следующим образом:
- Поражение костей. Сильнее всего патология затрагивает плоские кости и позвоночник. Они начинают болеть, могут случаться переломы. Дополнительно разрушается костная ткань. В самом тяжёлом случае может возникнуть экстренная ситуация — сдавливание спинного мозга, диагностируемое при помощи миелографии или МРТ.
- Амилоидоз почек. Из-за миеломы в канальцах повышается концентрация белковых субъединиц иммуноглобулинов, а внутри клубочков, то есть скопления капилляров, по которым проходит кровь, они откладываются в виде зернистых депозитов.
- Анемия. У более чем половины всех больных миеломой крови диагностируется пониженная концентрация гемоглобина, а также других форменных элементов крови.
- Предрасположенность к инфекционным заболеваниям. Подавляющее большинство больных становится очень восприимчивыми к бактериальным инфекциям, поскольку у них нарушено образование и снижено содержание нормальных антител, нейтрофилы дефектны, и их хемотаксис и миграция нарушены. Несмотря на то что клеточный иммунитет при этом обычно не снижается, смерть при миеломной болезни крови часто случается по причине инфекционных осложнений.
- Нарушение свёртываемости крови. Миелома проявляет себя увеличением времени кровотечения, однако они случаются у больных довольно редко.
- Болезнь Рейно. Присутствие аномальных белков криоглобулинов может привести к поражению мелких концевых артерий и артериол, из-за которых верхние фаланги пальцев приобретают цианотичную окраску.
Клиническая картина миеломной болезни достаточно выраженная, однако окончательно подтвердить наличие злокачественной опухоли из лимфоцитов можно только по результатам анализов. Для диагностики используются следующие исследования:
- Общий анализ крови. На болезнь указывает пониженное содержание гемоглобина и лейкоцитов с одновременным возрастанием количества тромбоцитов и увеличением скорости оседания эритроцитов.
- Биохимический анализ крови. При миеломе диагностируется увеличение содержания общего белка за счёт специфических иммуноглобулинов, повышение уровня кальция, креатинина, мочевины, лактадегидрогеназы, микроглобулина бета-2.
- Иммунохимическое исследование крови и мочи. При заболевании обнаруживаются патологические белки класса lgG, реже lgA, lgD или lgE.
- Общий анализ мочи. На миеломную болезнь указывает сывороточный парапротеин — белок Бенс-Джонса, продуцируемый плазматическими клетками.
- Пункция костного мозга. Если в биологическом материале костного мозга содержится более 10% плазматических клеток или они в каком-либо количестве присутствуют в других тканях, диагностируется миелома. Клетки при этом характеризуются округлым или овальным эксцентрично расположенным ядром, хроматин внутри которого имеет колесовидный рисунок, широкой интенсивной синей с чёткими границами цитоплазмой с вакуолями или без них.
- Рентгенологическое исследование костей. Для болезни характерно появление зон разрушенной костной ткани, очаги поражения черепа в виде гладкостенных пробоин, компрессионные переломы позвоночника.
- МРТ или КТ. Этими методами осуществляется дифференциальная диагностика для исключения заболеваний костей и определяется распространение болезни.
Если при исследованиях парапротеина и плазматических клеток менее 30 г/л и 10%, значит заболевание характеризуется как моноклональная гаммапатия неопределённого значения.
Сходные миеломе признаки имеют другие злокачественные опухоли: остеомиелит и лимфоплазмоцитарная лимфома. Исключить их помогают дополнительные исследования.
Костные метастазы могут возникать при злокачественной гемангиоме, заболевании лимфоидной ткани, раке симпатической нервной системы или молочной железы. От миеломы эти заболевания отличает наличие первичного опухолевого очага, а морфологию подтверждает гистологическое исследование.
Отличительной чертой лимфоплазмоцитарной лимфомы, вызывающей увеличение лимфатических узлов и селезёнки, поражение костного мозга и лёгких, является продуцирование моноклонального протеина и больших полипептидных субъединиц антител.
Если уровень кальция опасно повышен, амилоидоз привёл к почечной недостаточности, костно-мозговое кроветворение угнетено, кости болят и имеют множественные поражения и патологические переломы, есть опасения, что на спинной мозг оказывается давление. В этом случае необходима химиотерапия. Она может осуществляться в нескольких режимах:
- В самом простом варианте назначается монохимиотерапия с чередованием курсов цитостатиков. Из препаратов применяются Мелфалан и Циклофосфамид. Первый принимается в низких дозах (0,5 мг/кг) перорально в течение 4 дней с перерывом на 4—6 недель и чередуется с регулярными внутривенными вливаниями 16—20 мг/м2 через каждые 2 недели. Циклофосфамид вводится внутримышечно по 150—200 мг в сутки.
- Для больных с худшим прогнозом проводят полихимиотерапию. Для этого используются не только Мелфалан и Циклофосфамид, но и Преднизолон, Винкристин, Доксорубицин или Дексаметазон. Однако существует мнение, что, несмотря на большую интенсивность, такая программа не увеличивает ни количество и продолжительность ремиссий, ни выживаемость.
- Во время ремиссии после химиотерапии могут применяться препараты альфа-интерферона. При их внутримышечном введении в дозе 3—6 млн единиц трижды в неделю, период улучшения продлевается. Интерферон эффективен как в сочетании с другими препаратами, так и сам по себе.
- В случаях, когда болеют люди в возрасте менее 65 лет, в основном применяется высокодозная химиотерапия Мелфаланом с последующей трансплантацией донорского или собственного костного мозга. Это позволяет с высокой степенью эффективности увеличить безрецидивную и общую выживаемость.
Потенциальное излечение может произойти только в случае успешной донорской трансплантации костного мозга. Однако этот метод ограничивается возрастом пациента и высокой вероятностью смертности (5—10%) от токсического действия самого лечения. Поэтому обычно доступным остаётся только контроль течения болезни и обеспечение продолжительной ремиссии.
Если очаг разрастания плазматических клеток один, можно провести хирургическое лечение. Также оно, как дополнение к химиотерапии, показано при признаках сдавливания жизненно важных органов, особенно спинного мозга. Хирургическое лечение в таком случае заключается в удалении патологических образований или даже части позвоночной кости. Дополнительно назначаются глюкокортикоиды и проведение лучевой терапии.
Последняя улучшает качество жизни ослабленных больных и обычно назначается в сочетании с другими методами. Её проведение обязательно при почечной недостаточности и резистентности к химиотерапии. Как основное лечение, лучевая терапия используется при локальных костных поражениях.
Дополнительно должно осуществляться симптоматическое лечение, заключающееся во введении жидкостей и коррекции гиперкальциемии, а также приёме анальгетиков, гемостатической терапии и ортопедической помощи. В качестве препаратов, останавливающих разрушение костной ткани и предотвращающих переломы, обычно применяют Памидронат, Золедроновую кислоту или другие бисфосфонаты. В некоторых случаях анемии требуется назначение эритропоэтина и переливание эритроцитарной массы.
Миелому не следует путать с острым миелоидным лейкозом (ОМЛ) и заболеваниями, связанными с разрушением миелиновой оболочки нервных волокон. При ОМЛ подавляется рост нормальных клеток крови за счёт размножения изменённых лейкоцитов. И хотя его также в основном лечат при помощи химиотерапии, проявления и диагностика ОМЛ и миеломной болезни сильно отличаются друг от друга.
Демиелинизирующие заболевания приводят к ухудшению проводимости сигналов в пострадавших нервах. В результате возникает рассеянный склероз, синдром Гийена-Барре и прочие нарушения. Диагностируется разрушение миелиновой оболочки нейронов при помощи МРТ и электромиографии. Лечение зависит от того, какие нарушения возникли в результате демиелинизации.
источник
Что такое миеломная болезнь?
Будучи разновидностью гемобластоза. миелома представляет собой злокачественную опухоль. характеризующуюся ускоренным ростом плазмоцитов – клеток, вырабатывающих парапротеин (патологический белок).
Мутация, поразившая эти клетки, приводит к тому, что их число в тканях костного мозга и в крови неуклонно растёт. Соответственно, растёт и количество синтезируемого ими парапротеина.
На картинке изображен мазок костного мозга с множественной миеломой и без
Главным критерием злокачественности миеломы является многократно превышающее норму количество трансформированных плазмоцитов.
В отличие от онкологических заболеваний, имеющих чёткую локализацию (например, опухоли кишечника или яичников), миеломная болезнь характеризуется наличием раковых клеток сразу в нескольких внутренних органах, поскольку они могут разноситься вместе с током крови.
- Миеломная болезнь развивается при нарушении процессов правильного развития и преобразования В-лимфоцитов в клетки иммунной системы – плазмоциты. При этом неизбежно нарушается и процесс синтеза вырабатываемых ими иммуноглобулинов (антител, помогающих уничтожать патогенные вирусы и бактерии).
- Миелома – это злокачественная опухоль, образуемая постоянно размножающимися моноклональными плазмоцитами, которые не только не погибают, а бесконтрольно делятся и синтезируют парапротеины. Проникая (инфильтрируя) в ткани и внутренние органы, парапротеины препятствуют их нормальному функционированию.
- Миеломная болезнь развивается в основном у зрелых (старше сорока лет) и пожилых пациентов. Для молодых людей это заболевание не характерно. Чем старше пациент, тем выше у него риск развития миеломы, причём мужчин она поражает несколько чаще, чем женщин.
- Рост миеломы происходит чрезвычайно медленно. Момент образования первых плазмоцитов в тканях костного мозга и начало формирования опухолевых очагов могут разделять два и даже три десятилетия. Но после того как дадут о себе знать клинические проявления миеломной болезни, она начинает резко прогрессировать. Уже через два года после этого подавляющее большинство пациентов погибает от многочисленных осложнений, развившихся в тех органах и системах, которые были поражены парапротеинами.
Основанием для классификации миеломной болезни являются клинико-анатомические особенности нахождения плазмоцитов в тканях костного мозга, а также специфика их клеточного состава. От того, сколько органов или костей поражены опухолью, зависит подразделение миелом на солитарные и множественные.
- Солитарные миеломы отличаются наличием лишь одного опухолевого очага, расположенного либо в лимфатическом узле, либо в кости, имеющей костный мозг.
- Множественные миеломы всегда поражают сразу несколько костей, содержащих костный мозг. От миелом чаще всего страдают ткани костного мозга позвонков, лопаток, крыльев подвздошной кости, рёбер, костей черепа. Злокачественные опухоли нередко образуются в центральной части трубчатых костей верхних и нижних конечностей. Столь же уязвимыми оказываются селезёнка и лимфоузлы.
В зависимости от расположения плазмоцитов в костном мозге миеломы бывают:
- диффузно-очаговыми;
- диффузными;
- множественно-очаговыми.
Клеточный состав миелом позволяет разделить их на:
- плазмоцитарные;
- плазмобластные;
- полиморфноклеточные;
- мелкоклеточные.
Как и у большинства онкологических заболеваний. подлинные причины миеломной болезни до сих пор не установлены. Столь же мало изучен характер и степень воздействия патогенных факторов на трансформацию повреждаемых клеток.
Медики предполагают, что основными причинами миеломной болезни можно считать:
- Генетически обусловленную предрасположенность. Этот недуг часто поражает очень близких родственников (им нередко страдают однояйцевые близнецы). Все попытки выявить онкогены, провоцирующие развитие заболевания, пока не имели успеха.
- Длительное действие химических мутагенов (в результате вдыхания паров ртути и бытовых инсектицидов, асбеста и веществ, полученных на основе бензола).
- Воздействие всех видов ионизирующих излучений (протонов и нейтронов, ультрафиолета, рентгеновских и гамма-лучей). Среди населения Японии, пережившего трагедию Хиросимы и Нагасаки, миеломная болезнь встречается чрезвычайно часто.
- Наличие хронических воспалений, требующих от организма пациента продолжительного иммунного ответа.
Объём поражения и тяжесть течения позволяют выделить три стадии миеломной болезни. При первой стадии опухолевый процесс укладывается в следующие параметры:
- В крови содержится достаточное количество кальция.
- Уровень концентрации гемоглобина превышает 100 г/л.
- В крови ещё немного парапротеинов.
- Белок Бенс-Джонса в моче присутствует в очень небольшой (не более 4 г за одни сутки) концентрации.
- Общая масса миеломы не превышает 600 г на квадратный метр.
- В костях отсутствуют признаки остеопороза.
- Опухолевый очаг находится лишь в одной кости.
Третья стадия миеломы характеризуется наличием следующих параметров:
- Содержание гемоглобина в крови составляет менее 85 г/л.
- Содержание кальция в 100 мл крови превышает 12 мг.
- Опухолевые очаги захватили сразу три кости (или более).
- В крови очень высоко содержание парапротеинов.
- Очень высокой (свыше 112 г за сутки) является концентрация белка Бенс-Джонса.
- Общая масса раковых тканей составляет более 1,2 кг.
- Рентгенограмма показывает наличие остеопороза в поражённых костях.
Вторую степень миеломы, показатели которой выше, чем при первой, но не дотягивают до третьей, доктор устанавливает методом исключения.
Миеломная болезнь прежде всего поражает иммунную систему, ткани почек и костей.
Симптоматика определяется стадией недуга. На первых порах она может протекать бессимптомно.
При увеличении количества раковых клеток миелома проявляется следующими признаками:
- Ноющими болями в костях. Раковые клетки приводят к образованию пустот в костных тканях.
- Болями в сердечной мышце, сухожилиях и суставах . обусловленными отложением в них парапротеинов.
- Патологическими переломами позвонков, бедренных костей и рёбер. Из-за большого количества пустот кости становятся настолько хрупкими, что не выдерживают даже незначительных нагрузок.
- Снижением иммунитета . Поражённый болезнью костный мозг вырабатывает такое незначительное количество лейкоцитов, что организм пациента не способен защищать себя от воздействия патогенной микрофлоры. В результате больной страдает от бесконечных бактериальных инфекций – отитов, бронхитов и ангин.
- Гиперкальциемией. Разрушение костных тканей приводит к попаданию кальция в кровь. При этом у больного развиваются запоры, тошнота, боли в животе, слабость, эмоциональные расстройства и заторможенность.
- Миеломной нефропатией – нарушением правильной работы почек. Избытки кальция приводят к образованию камней в почечных протоках.
- Анемией. Повреждённый костный мозг вырабатывает всё меньше эритроцитов. В результате количество гемоглобина, отвечающего за доставку кислорода в клетки, также снижается. Кислородное голодание клеток проявляется в сильной слабости, снижении внимания. При малейших нагрузках больной начинает страдать от сердцебиения, головных болей и одышки.
- В нарушении свертываемости крови. У одних пациентов увеличивается вязкость плазмы, из-за которой спонтанно склеивающиеся эритроциты могут образовать тромбы. Другие пациенты, в крови которых резко снизилось количество тромбоцитов, страдают от частых носовых и дёсенных кровотечений. При повреждении капилляров у таких больных происходят подкожные кровоизлияния, проявляющиеся в образовании большого количества синяков и кровоподтёков.
Диагностика миеломной болезни начинается с предварительного врачебного осмотра. Собирая анамнез, специалист подробно расспрашивает пациента о существующих жалобах и особенностях клинической картины, не забывая уточнить время их появления.
После этого следует этап обязательного прощупывания болезненных участков тела с серией уточняющих вопросов о том, не происходит ли усиление боли и присутствует ли её отдача в другие участки тела.
Собрав анамнез и придя к выводу о возможности миеломной болезни, специалист назначает пациенту ряд таких диагностических исследований:
- Рентгеноскопию грудной клетки и скелета.
На фото представлен рентген кости руки, показывающий миеломную болезнь
- Магнитно-резонансную и компьютерную томографию (спиральную).
- Аспирацию тканей костного мозга, необходимую для создания миелограммы.
- Лабораторный анализ мочи (по Зимницкому и общий). Анализ по Зимницкому позволяет проследить суточную динамику утраты белка в урине. Анализ мочи на белок бенс-джонса проводится для того, чтобы убедиться в правильности поставленного диагноза, поскольку моча здорового человека его не содержит.
- Белки бенс-джонса могут быть выявлены и во время процедуры иммуноэлектрофореза.
- Для оценки общего состояния кроветворной системы проводят общий анализ 1 мл крови. взятой из вены или из пальца. О наличии миеломной болезни будут свидетельствовать: повышение СОЭ, значительное снижение содержания гемоглобина, эритроцитов, ретикулоцитов, тромбоцитов, лейкоцитов и нейтрофилов, а вот уровень моноцитов будет повышенным. Увеличение общего количества белков достигается за счёт содержания парапротеинов.
- Чтобы оценить функционирование отдельных систем и органов, проводят биохимический анализ крови. взятой из вены. Диагноз миеломной болезни подтверждает комплекс показателей в крови, среди которых: повышенный уровень общего белка, мочевины, креатинина, мочевой кислоты, кальция при понижении содержания альбумина.
- Ведущим методом лечения миеломной болезни является химиотерапия, сводящаяся к приёму высоких доз цитостатических препаратов.
- После эффективной химиотерапии пациентам проводят трансплантацию донорских или собственных стволовых клеток.
- При низкой эффективности химиотерапии применяют методы лучевой терапии. Воздействие радиоактивных лучей не исцеляет пациента, но на некоторое время позволяет существенно облегчить его состояние, к тому же, увеличив продолжительность его жизни.
- От мучительных болей в костях избавляются при помощи обезболивающих препаратов.
- Инфекционные заболевания лечат высокими дозами антибиотиков.
- Справиться с кровотечениями помогут гемостатики (типа викасола и этамзилата).
- От опухолей, сдавливающих внутренние органы, избавляются хирургическим путём.
Если химиотерапия прошла удачно, пациенту пересаживают его собственные стволовые клетки. Для забора костного мозга выполняют пункцию. Выделив из него стволовые клетки, снова подсаживают их в организм пациента. С помощью этой манипуляции удаётся достичь стойкой ремиссии, на протяжении которой пациент ощущает себя здоровым.
- Диета при миеломной болезни должна быть низкобелковой. Суточное количество потребляемого белка не должно превышать 60 г.
- В крайне малом количестве следует употреблять фасоль, чечевицу, горох, мясо, рыбу, орехи, яйца.
- Все прочие продукты, хорошо воспринимаемые пациентом, можно смело включать в рацион.
Современные методы лечения позволяют продлить жизнь больного, страдающего миеломной болезнью, почти на пять лет (в очень редких случаях – до десяти). При полном отсутствии терапевтической помощи он может прожить не более двух лет.
Продолжительность жизни пациентов зависит исключительно от их восприимчивости к воздействию цитостатических препаратов. Если цитостатики не оказывают на больного никакого положительного терапевтического эффекта (медики называют это первичной резистентностью), он может прожить не более года.
Если лечение цитостатическими препаратами осуществляется в течение продолжительного времени, у пациента может развиться острый лейкоз (частота таких случаев составляет до 5%). Случаи развития острого лейкоза у пациентов, не получавших такого лечения, чрезвычайно редки.
Ещё одним фактором, влияющим на продолжительность жизни пациентов, является стадия диагностирования заболевания. Причинами летальных исходов могут стать:
- сама прогрессирующая опухоль (миелома);
- заражение крови (сепсис);
- инсульт;
- инфаркт миокарда;
- почечная недостаточность.
источник
Анализ периферической крови показывает, у большинства больных с множественной миеломой, наличие анемии. Эта анемия, обычно умеренная, гипохромного типа может быть иногда сильно выраженной (менее 1 миллиона гематий/мм3). На мазке наблюдаются аспекты анизоцитоза и пойкилоцитоза. Гематии проявляют часто тенденцию располагаться в виде «монетных столбиков»,—явление, связанное с наличием миеломатозных протеинов в сыворотке и с их скоплением на поверхности гематий. Количество Гб также понижено.
Число лейкоцитов, вариабильное, нормальное или повышенное. В развитых стадиях болезни можно наблюдать лейкопении, отягощаемые и применяемыми цитостатическими лечениями. Лейкоцитарная формула, обычно нехарактерная, может показывать иногда повышенное число плазмоцитарных элементов, подобных клеткам в костном мозге.
Число тромбоцитов нормальное или умеренно пониженное.
Исследование костного мозга при множественной миеломе имеет важнейшее значение для постановки диагноза. Костная пункция производится обычно в грудную кость или в подвздошный гребень, но ее можно производить и в другие затронутые кости: позвонки, пяточную кость, ключицу. Иногда проникание в кость происходит очень легко, костная ткань давая ощущение особой хрупкости.
Для миеломы характерен численный рост плазмоцитарной серии, которая может составлять 90% клеточного населения костного мозга. Вообще, при 20% плазмоцитарных элементов ставится вопрос о существовании миеломы. Аномалийные плазмоцитарные элементы или так называемые «миеломатозные клетки», это клетки диаметром в 15—30(л, круглые или овальные. Ядро, диаметром в 5—7у., круглое, расположенное эксцентрично, содержит 1—2 нуклеоли. Нуклеарный хроматин менее комковатый и уже не представляет тот регулярный порядок, который наблюдается в нормальном плазмоците. Цитоплазма этих клеток интенсивно базофильная, становится яркосиней при окрашивании May-Grunwald-Giemsa (цветная вклейка III).
В цитоплазме миеломатозных клеток можно встретить гиалиновые шарики (тела Russel), многочисленные вакуоли, придающие клетке вид ежевики (клетки Mott), или хрустальные азурофильные включения иногда подобные телам Auer при миелобластической лейкемии (протеиновые кристаллы) (цветная вклейка III).
Вариабильное число клеток может иметь 3 или более ядер. Другие имеют сильно выраженные черты незрелости: они более крупных размеров (20—35u) с болыпдм, круглым ядром, с очень тонким хроматином, а цитоплазма интенсивно базофильная. Встречаются также и несколько зрелых плазмоцитарных клеток, с ядром в виде «колесной спицы » и ясной перинуклеарной зоной. Иногда плазмоциты могут иметь ацидофильную цитоплазму, так называемые «пламенистые клетки » (flaming cells) (цветная вклейка III).
С цитохимической точки зрения, цитоплазма миеломатозных клеток является пероксидазо-отрицательной и окрашивается метахроматически с метиловой зеленью. Гиалиновые шарики (тела Russel) обычно PAS-положительные.
Миеломатозные клетки преставляют множество нуклеоцитоплазматических асинхронизмов созревания. Согласно Bernier и Graham, степень этих асинхронизмов пропорциональна клиническому распространению заболевания.
Исследования при помощи электронного микроскопа показали наличие определенных аномалий на уровне клеточных органитов, аномалии тем более явные, чем менее дифференцирована миеломатозная клетка. Митохондрии численно увеличены и имеют патологические аспекты: удлиненные, кольцевидные, иногда с чертами миелиновой дегенерации; аппарат Гольджи везикулярнио трансформирован, центриоли имеют гигантский удлиненный вид, а число рибозомов может возрастать (Bessis). Наиболее интересный аспект представляет эргастоплазмический аппарат. В большинстве случаев он расширен и имеет везикулярный вид.
Содержимое эргастоплазмических везикул состоит из протеина и имеет твердую консистенцию, принимая аспект тел Russel, либо в растворимой форме, flaming cells или тезауроцотив (Paraskevas и сотр.), либо в кристаллизованной форме.
Протеиновые кристаллы бирефрингентные с периодичностью около 110 A (Bessis). В других случаях эргатоплазмический аппарат менее развит и представлен несколькими пластинками, а редко бывает плохо развитым, подобным лимфоидной клетке. На уровне ядра появляются аномалийные, гипертрофированные нуклеоли, а также и множество интрануклеарных вакуолей (Smetena и сотр.). Некоторые авторы описали наличие в ядре вирусных телец, в 15% случаев (Sorensen), тельца, которые Bessis нашел лишь в одном из 12 изученных им случаев.
Иммунохимические и иммунофлюоресцентные исследования, с разными специфическими антисыворотками (IgG, IgA, IgM, IgD IgE, ламбда, каппа) показали наличие Ig в цитоплазме миеломатозных клеток. Они локализированы в особенности на уровне эргастоплазмического аппарата и рибозомов. Делались попытки установить связь между морфологическим аспектом клеток и типом секретированного Ig. Полученные до настоящего времени результаты неубедительны. Paraskevas и сотр. утверждают, что пламенистые клетки секретируют IgA.
Цитогенетическое исследование множественной миеломы показало существование разных форм анейплоидии, но которые наблюдаются не во всех случаях. Кроме этого кыло описано и присутствие различных хромозомов маркеров. Вследствие внедрения метода бандирования, Liang и Rowley нашли хромозом 14р+ у 3 больных с множественной миеломой и 1 больного с плазмоцитарной лейкемией, из 22 изученных больных. Этот хромозом 14q+ был найден и при других лимфомах типа Б, а также, изредка, и при лимфомах non-Б. Следует отметить, что Croce и сотрудники установили, что структуральные гены для тяжелых цепей Ig локализированы у человека на хромозоме 14.
Исследование протеинового обмена при множественной миеломе. Расстройства протеинового метаболизма составляют характерный аспект множественной миеломы. Злокачественно модифицированные плазмоциты сохраняют и усиливают способность синтетизировать цельные Ig или только определенные составные части глобулиновой молекулы.
Изменения протеинового метаболизма проявляются в трех формах:
1) появление сывороточной гипериротеинемии;
2) выведение протеинов через мочу и
3) отложение на уровне тканей аномалийных протеиновых веществ, известных под названием «амилоид» или «параамилоид».
В сыворотке большинства больных, общее количество протеинов повышено, достигая 23 г/100 мл. Среднее количество сывороточных протеинов у больных с миеломой равняется 9 г/100 мл. Этот рост происходит за счет глобулинов, точнее Ig. При электрофорезе на бумаге или в агаре наблюдается появление узкой и высокой полосы, с заметным сокращением остальных дуг. Это является изображением количественного роста гомогенного населения глобулинов. Пик находится обычно в зоне миграции у-глобулинов или b-глобулинов. Аномалийный протеин, находящийся в сыворотке больных с миеломой, получил название парапротеина, миеломатозного глобулина (М-глобулин) или компонента М.
В рамках множественной миеломы может происходить:
1) избыточный синтез, однако уравновешенный, цепей Н и L, с образованием цельных Ig;
2) неуравновешенный синтез, с избытком цепей L и образованием цельных Ig, параллельно с повышенным количеством свободных цепей L и
3) синтез лишь цепей L.
В настоящее время миеломы делятся по типу секретируемого Ig: миеломы IgG наиболее частые, встречающиеся в 60% случаев; миеломы IgA, в 20—25% случаев; IgD, в 2,1% случаев; и ограниченное число миелом IgE. Среди случаев множественной миеломы, 20% — с цепями L (миеломы Бенс-Джонса), причем некоторые без патологического протеина в сыворотке, так как он элиминируется через мочу. Очень малый процент заболеваний (1%) не представляет изменений протеинового метаболизма (несекретирующие миеломы).
В рамках миелом IgG, наблюдается следующее распределение на субклассы (Schur): yG1 60—82%; yG2 10—18%; yG3 6—15%; yG4 1—8%. Сравнивая эти цифры с относительными концентрациями в нормальной сыворотке (гл. 7) можно утверждать, что моноклональные Ig типа yGl и yG3 встречаются чаще по сравнению с yG2.
Характерной чертой миеломатозного Ig является его гомогенность: узкая зона электрофоретической миграции, индивидуальная антигенная специфичность и цепь L только одного типа (ламбда или каппа). При миеломах IgG и IgA преобладают случаи с цепями каппа (2/3 случаев) (Hobbs и Corbet); при миеломах IgD, цепи ламбда преобладают в 90% случаев, в то время как при миеломах Бенс-Джонса, цепи ламбда присутствуют приблизительно в 45% случаев (Jancelewicz и сотр.). До сих пор не удалось выявить физико-химические или иммунохимические различия между миеломатозными протеинами и соответствующими им нормальными Ig.
Было доказано, что миеломатозные Ig обладают способностью связываться с другими веществами, следовательно действовать как антитела. Такая антителовая деятельность отмечалась по отношению к бактериальным соединениям (стрептолизин 0 или спрептококковая гиалу-ронидаза), к гематиям, к некоторым сывороточным протеинам, а также и к гаптенам (динитрофенол, 5-ацетоурацил, пуриновые и пиримидиновые нуклеотиды) (Osterland и сотр.). Способность миеломатозного протеина связываться с гематиями или сывороточными протеинами порождает определенные симптомы, как например агглютинация гематий в виде монетных столбиков, явления повышенной кровоточивости и пр.
У больных с миеломой, количественный рост характерного миеломатозного Ig сопровождается сокращением производства других типов глобулинов.
Значительная диспротеинемия в крови больных с множественной миеломой оказывает влияние на все пробы коллоидальной лабильности.
Реакция оседания эритроцитов в большинстве случаев бывает очень ускоренной, достигая 100 мм в час. При миеломах Бенс-Джонса, РОЭ показывает более низкие цифры, иногда даже в нормальных пределах.
Реакции на формол-гелифицирование, сульфат кадмия, Вельтмана — положительные. Реакция Sia (помутнение сыворотки в дистилированной воде) — слабо или умеренно положительная.
В редких случаях отмечалось наличие сывороточных криоглобулинов с появлением синдрома Рейно на холоде и наблюдалось также наличие пироглобулинов.
Тесты на коагуляцию модифицированы у некоторых больных. Патологические протеины в сыворотке могут интерферировать с различными фазами коагуляции, как например в трансформация фибриногена в фибрин, во взаимодействии с факторами II, V и VII. Функции тромбоцитов могут быть также модифицированными.
Анализ мочи показывает наличие протеина Бенс-Джонса в 40—50% случаев, когда он детерминируется путем нагревания и в 61% случаев, когда он выявляется путем иммуноэлектрофореза. Он представлен выведением легких цепей. Протеин Бенс-Джонса преципитирует в моче нагретой до 50—60°, создавая беловатое облако, которое перерастворяется при кипячении. В случае ассоциированной альбуминурии, перерастворение является неполным и иногда оказывается неполным и без альбуминурии. В такой ситуации мочу можно сделать прозрачной путем добавления нескольких капель 5%-й уксусной кислоты. Физикохимическое исследование альбумина Бенс-Джонса показало, что он состоит из легких цепей, димеризованных дисульфидными связями. Постоянно легкая цепь в моче идентична с легкой цепью сывороточного миеломатозного протеина.
В мочевом осадке могут появляться цилиндры, гематии, а в случаях почечного калкулеза появляются кристаллы фосфатов, уратов, а также гематии и лейкоциты.
Гиперкальцемия встречается часто при множественной мизломе (20—53% случаев), достигая 12—16 мг/100 мл сыворотки. Этот рост связан в первую очередь с процессами костной деструкции, но и с гиперпаратиреоидизмом, как вторичное явление почечной недостаточности. Гиперкальцемия при множественной миеломе не сопровождается ростом фосфора в крови, а щелочные сывороточные фосфатазы находятся в нормальных пределах, что представляет ценные данные для дифференциальной диагностики по отношению к первичному гиперпаратиреоидизму.
Сывороточная мочевая кислота бывает часто повышена, а в случаях, осложняющихся почечной недостаточностью, наблюдается рост креатинина и непротеинового азота.
Патологоанатомическое исследование при множественной миеломе. Наиболее явные изменения встречаются на уровне скелета, особенно в черепных костях, позвонках, ключицах, ребрах, грудной кости, лопатке, тазовых костях. Длинные кости затронуты в меньшей мере. На срезе, кость оказывается мягкой, а нормальная ткань заменяется красноватой или серо-красноватой туморальной тканью. Иногда опухоль переходит за периост, инфильтрируя смежные участки.
Микроскопически, туморальная ткань состоит из пролиферации злокачественных плазмоцитоидных клеток, описанных при исследовании костного мозга. На срезе остеокласты и остеобласты немодифицированы.
В редких случаях внекостных миелом можно обнаруживать плазмоцитарные опухоли в различных органах, причем характерные особенности пролиферированных клеток подобны тем, которые наблюдаются при костных опухолях.
При множественной миеломе почка бывает часто затронута. Наиболее важные поражения встречаются на уровне канальцев. Дистальные канальцы расширены, с уплощенным эпителием и просветами заполненными эозинофильными и полихроматофильными цилиндрами. На периферии этих цилиндров встречаются многоядерные синцитин эпителиальных клеток. Цилиндры состоят из цельного миеломатозного Ig или из цепей L (протеин Бенс-Джонса). На электронном микроскопе, эти цилиндры имеют фибрилярную, амилоидную структуру (Abrahams и сотр.). Не удалось установить несомненную связь между наличием амилоида и протеинурией Бенс-Джонса. Несмотря на это, Glenner и сотр. показали in vitro образование амилоидных волокон путем протеолитической дигестии человеческого протеина Бенс-Джонса. Возможно, что подобный процесс происходит и на уровне почечных канальцев (Zlotnick).
В тубулярных эпителиальных клетках часто встречаются отложения кальция. Также на уровне почечных канальцев было отмечено наличие кристаллов, находящихся как в просвете, так и в эпителии. Их химическая структура не была установлена.
Почечные гломерулы бывают реже затронутыми при множественной миеломе. Отмечается утолщение базальной мембраны и мезангиомы, которое выступает с особенной ясностью на электронном микроскопе. Встречается также и гипертрофия эндотелиальных и эпителиальных клеток. В развитых фазах болезни появляются гиалиноз и склероз. Иногда в гломерулах можно найти отложения амилоида, что приводит к его гомогенизации.
Почечная интерстициальная ткань представляет инфильтрационные поражения, либо благодаря миеломатозным клеткам, либо благодаря клеткам хронического воспаления.
В общей сложности, эти поражения составляют аспект «миеломатозной клетки».
источник
Миеломная болезнь (миелома, плазмоцитома, миеломатоз и болезнь Рустицкого-Калера) – это тяжёлое заболевание кроветворной системы, которое чаще всего определяется на поздних стадиях протекания и вследствие этого имеет неутешительные прогнозы. Своевременно начатое лечение позволяет продлить жизнь пациента и достигнуть относительно длительной ремиссии. Поэтому ранняя диагностика миеломной болезни – важный вопрос для всех людей, находящихся в группе риска.
Миеломатоз – самое распространённое заболевание в группе раковых опухолей плазматических клеток крови. Частота встречаемости миеломной болезни составляет до 1 % всех случаев онкологии и около 10 % случаев рака крови. Ежегодно среди 1 миллиона населения мира обнаруживается 30 новых случаев миеломы.
При данном виде онкологии происходит мутация одного из видов клеток крови – плазмоцитов. Плазмоциты или плазматические клетки – это конечная форма В-лимфоцитов. Их функция состоит в распознавании чужеродных агентов и выработке специфичных к ним антител (иммуноглобулинов).
При мутации происходит патологическое размножение (пролиферация) одного из клонов плазматических клеток. Изменённые плазмоциты вырабатывают патологический иммуноглобулин – парапротеин, который является основным маркером миеломатоза при дифференциальной диагностике.
Болезни подвержены в основном пожилые пациенты, организм которых не в состоянии переносить тяжёлые интенсивные курсы химиотерапии. Поэтому срок между появлением первых мутировавших плазмоцитов и диагностикой заболевания непосредственно влияет на прогнозы выживаемости. При этом рост числа патологических клеток и развитие миеломной болезни могут происходить чрезвычайно медленно. От появления первых плазмоцитов с мутациями до образования очагов миеломы может проходить 20-30 лет.
Переломный момент наступает после проявления клинических признаков заболевания. Миелома начинает быстро прогрессировать. Избыток парапротеина негативно влияет на висцеральные органы (в основном на выделительную систему) и кости организма.
Миеломы классифицируются в зависимости от особенностей расположения изменённых плазмоцитов в здоровых тканях костного мозга и специфики их состава. В зависимости от локализации патологических клеток в кроветворных тканях различают диффузную, диффузно-очаговую и множественную (множественно-очаговую) форму заболевания.
Состав клеток позволяет классифицировать миеломатозные опухоли на плазмобластные, плазмоцитарные, мелко- и полимфортноклеточные. Вид атипичных плазмоцитов определяется при тканевом (гистологическом) исследовании. Эта характеристика позволяет спрогнозировать скорость роста опухоли.
Одна из распространённых в медицинской практике классификаций учитывает также особенности локализации патологического очага (очагов) в костной системе и внутренних органах.
Солитарные или одиночные миеломатозные опухоли располагаются в кости, содержащей костномозговую ткань, либо в лимфоузле. Лимфоузлы непосредственно участвуют в реакции иммунитета на инфекционных агентов, поэтому нередко поражаются миеломной болезнью.
Множественные очаги миеломатоза занимают сразу несколько мест. Особенно уязвима для мутировавших плазмоцитов костномозговая ткань позвоночника, подвздошных и черепных костей, лопаток, ребёр. Нередко очаги опухоли образовываются в селезёнке, нескольких лимфоузлах и центральной части трубчатых костей ног и рук.
При подозрении на множественную миелому, а также рецидиве солитарной неоплазии плазматических клеток проводится полное исследование тела методами томографии.
На раннем этапе заболевание может протекать практически без симптомов. Когда количество патологически изменённых клеток достигает критического значения, и миелома образует солитарный или множественный очаг, проявляются клинические признаки плазмоцитарного рака.
Основные симптомы миеломной болезни:
- ноющие боли в костях конечностей, лопаток, черепа или позвоночника;
- тянущие боли в сердце и суставах (вызваны отложением амилоида – формы хранения парапротеинов во внутренних органах);
- частые бактериальные инфекции;
- патологические переломы костей конечностей, рёбер и позвонков;
- слабость, заторможенность когнитивных функций, нарушения работы ЖКТ (обусловлены гиперкальциемией – высвобождением кальция из растворённой костной ткани в кровь);
- анемия;
- учащённое сердцебиение (как результат компенсаторного механизма в ответ на недостаток эритроцитов);
- одышка, головная боль;
- деформация грудной клетки вследствие изменения костной ткани;
- нефропатия (нарушение функции почек вследствие образования кальциевых камней в их протоках);
- снижение свёртываемости крови (с образованием множественных кровоподтёков), нередко – на фоне роста вязкости плазмы (в результате при частых кровотечениях у пациента могут образовываться тромбы).
У каждого десятого больного патологические плазмоциты не продуцируют парапротеин. В результате даже на стадии обширного развития миеломы заболевание протекает бессимптомно.
Интенсивность проявления симптомов и их перечень зависит от стадии болезни, её типа (например, при множественном миеломатозе в первую очередь фиксируют переломы и гиперкальциемию) и сопутствующих хронических заболеваний.
Признаки миеломы на разных стадиях
| Диагностические признаки | 1-я стадия | 2-я стадия | 3-я стадия |
|---|---|---|---|
| Остеопороз (хрупкость, разрушение костей) | Признаки остеопороза отсутствуют или наблюдаются в зоне миеломатозного очага | Признаки разрушения присутствуют, но не столь явные, как при 3-й стадии болезни | Наблюдается интенсивный остеопороз |
| Количество костей с миеломатозным очагом | Одиночная миелома | 1-2 | 3 и более костей поражено опухолью |
| Гиперкальциемия | >2,55 ммоль/л | >3 ммоль/л | |
| Уровень гемоглобина | >100 г/л | Анемия 1-й или 2-й степени | |
| Концентрация белка Бенс-Джонса | от 4 до 12 г белка в суточной моче | >12 г/сутки | |
| Сывороточные парапротеины | Менее 5 г/дл (IgG) Менее 3 г/дл (IgА) | Промежуточные значения | Более 7 г/дл (IgG) Вторая стадия болезни определяется чаще методом исключения, если показатели не соответствуют критериям 1-й и 3-й.Белок Бенс-Джонса является соединением, которое выделяется плазматическими клетками. В силу небольшой молекулярной массы оно сразу выводится почками, что делает его наличие важным диагностическим признаком при обследовании пациентов. Для определения миеломной болезни диагностика должна включать визуальные, аппаратные и лабораторные методы исследования. При осмотре хирург или онколог расспрашивает пациента о жалобах и времени проявления неприятных симптомов, измеряют частоту пульса, пальпируют болезненные участки костей, фиксируя, усиливается ли боль при нажатии. Также оценивается цвет кожного покрова (бледность может говорить об анемии), наличие синяков и кровоподтёков, припухлостей в местах частой локализации опухоли. При подозрении на миеломатоз пациенту назначают ряд исследований. Перечень аппаратных методов диагностики, которые применяются для выявления миелом, включает:
Все три метода позволяют выявить участки сниженной плотности костной ткани и дифференцировать патологию от других заболеваний опорно-двигательного аппарата. При поражении множественной миеломой на рентгенограмме отчётливо заметно, что кости черепа, позвоночника, лопаток и конечностей испещрены тёмными пятнами остеолитических повреждений. При солитарной (одиночной) опухоли нарушение плотности наблюдается лишь в месте её локализации. Томография является более информативным и полным методом. Она позволяет отследить костные поражения всего опорно-двигательного аппарата за короткое время и без облучения отдельных частей тела. Инструментальная диагностика включает забор пробы (пункцию) костного мозга для составления миелограммы. Миелограмма – это результат анализа биоматериала (миелоидной ткани), в которой указаны качественный и количественный составы костного мозга. Это исследование даёт возможность дифференцировать заболевание с другими видами рака крови. Основным диагностическим симптомом миеломы является патологически повышенная доля плазматических клеток (более 10-30 % при норме до 1,5 %). Параллельно с плазмоцитами может повышаться содержание недифференцированных бластов (норма составляет до 1,1 %). Содержание эритробластов, лимфоцитов и других кроветворных клеток, напротив, значительно снижено. Ключевая роль в постановке диагноза «миелома» отводится не только анализу миелоидной ткани, но и лабораторной диагностике (пробам крови и мочи). Для диагностики миеломатоза используются такие методы исследования:
Результаты общего анализа крови при миеломе значительно отличаются от нормы. Уровень гемоглоибна, а также количество тромбоцитов, лейкоцитов, эритроцитов, ретикулоцитов (предшественников красных кровяных клеток), нейтрофилов снижается. Растут скорость оседания эритроцитов (что свидетельствует о патологии без указания на её генез) и доля моноцитов в лейкоцитарной формуле. В пробе могут обнаружиться 1-2 плазмоцита. В общем анализе мочи определяются цилиндры, эритроциты и лёгкие цепи парапротеина (белки Бенс-Джонса). Выделяемая жидкость имеет более высокую плотность, чем у здорового человека (в основном за счёт патологических белков). В биохимическом анализе наблюдаются признаки поражения почек (повышенный уровень концентрации мочевой кислоты, мочевины и креатинина) и гиперкальциемии. На фоне малого количества альбумина за счёт присутствия парапротеина фиксируется аномально высокая концентрация общего белка. Иммуноэлектрофорез проводится для определения парапротеинов в моче или плазме крови. В зависимости от типа патологических клеток во время анализа могут быть выявлены парапротеины классов IgА (IgD, IgE, IgG) или бета-2 микроглобулины (уровень последнего указывает на стадию болезни). В качестве дополнительных методов диагностики используются анализы на концентрацию L-лактата (маркера повреждения тканей), электролитов и С-реактивного белка (его концентрация влияет на уровень содержания фактора роста миелом – интерлейкина-6). После постановки диагноза специалист-онколог проводит анализ для определения перспектив и скорости роста опухоли (индекс мечения плазмацитов). Симптоматика миеломатоза нередко напоминает проявление более распространённых заболеваний онкологического и доброкачественного генеза. Наибольшую сложность представляет дифференцирование признаков плазмоцитомы и доброкачественной моноклональной гаммапатии. Доброкачественные гаммапатии также характеризуются образованием клонов иммуноглобулинпродуцирующих клеток, однако рост их количества не происходит или происходит очень медленно. Концентрация моноклональных иммуноглобулинов в сыворотке крови не превышает 3 г/дл, а доля плазмоцитов в костномозговой ткани составляет до 5 %. Поражения костей и гиперкальциемия не фиксируются. Гаммапатия является наиболее частой причиной парапротеинемии (повышенного количества патологического белка в крови). По статистике, она наблюдается у 1-1,5 % людей старше 50 лет и у 3-10 % людей старше 70 лет. Это состояние не требует срочного лечения, но обязательно наблюдается врачами, т. к. в 16 % случаев оно способно развиться в миеломную болезнь, а в 17 % и 33 % (в течение 10 и 20 лет соответственно) – в другие виды гемобластозов. В половине случаев повышенное количество патологического белка наблюдается в течение всей жизни пациента, но не становится причиной его смерти. Дифференциальная диагностика с другими причинами остеолитических повреждений (низкая секреция эстрогенов, болезнь Реклингаузена, старческий остеопороз, метастазы карциномы предстательной и щитовидной желёз) производится по анализу концентрации парапротеинов и миелограмме. Схожесть с симптомами миеломы имеют и признаки болезни Вальденстрёма. Наблюдаются характерное повышение моноклональных иммуноглобулинов (IgM), избыточная выработка парапротеинов и повышенное количество лимфоплазмоцитарных клеток. Отличие заключается лишь в отсутствии литических поражений костей, что определяется на томографии. Дифференциальная диагностика миеломатоза и других синдромов, связанных с парапротеинемией, проводится также при почечной недостаточности невыясненной этиологии. Ранняя диагностика миелом возможна только при регулярном проведении общих клинических анализов и почечных проб (биохимии крови). Если пациент бережно относится к своему здоровью и ежегодно отслеживает динамику результатов, то у него есть все шансы обратиться к врачу задолго до появления клинических признаков миеломатоза и с помощью интенсивной терапии достигнуть длительной ремиссии заболевания. Мы будем очень благодарны, если вы оцените ее и поделитесь в социальных сетях источник |